|
|
|
SPECIALIZAREA MEDICINĂ GENERALĂ
LUCRARE DE DIPLOMĂ
OXIHEMOGLOBINEI
ÎN ŞOCUL TRAUMATIC
Coordonator: Prof. univ. dr. Badiu Gheorghe
Îndrumător: As. univ. dr. Lilios Gabriela
Absolvent: Alexandrescu Vlad Mircea

ELEMENTE DE FIZIOPATOLOGIE ALE ŞOCULUI TRAUMATIC
EFECTUL ŞOCULUI TRAUMATIC ASUPRA ÎNTREGULUI ORGANISM
SINDROMUL DE INSUFICIENŢĂ MULTIPLĂ DE SISTEME ŞI ORGANE
VALORI NORMALE ALE UNOR CONSTANTE BIOLOGICE FOLOSITE ÎN CADRUL LUCRĂRII
Lucrarea de Diplomă: "Studiul variaţiei oxihemoglobinei în şocul traumatic" a studentului Alexandrescu Vlad Mircea - Facultatea de Medicină, Universitatea "Ovidius", Constanţa
Lucrarea tratează un subiect deosebit de interesant din domeniul urgenţelor medico-chirurgicale - şocul traumatic, care rămâne în atenţia cercetării medicale, atât prin incidenţă, gravitate, cât şi prin complexitatea mecanismelor etiopatogenice incomplet elucitate încă.
Stu
diul dinamicii oxihemoglobinei reprezintă unul din aspectele fiziopatologiei şocului traumatic care suscită interesul deopotrivă al fiziopatologilor şi al clinicienilor, dată fiind relativa sa accesibilitate practică şi valoarea sa în diagnosticul, controlul terapeuticii şi evaluarea prognostică a şocaţilor traumatici.Complexitatea temei a impus o abordare interdisciplinară, fiziopatologică şi clinică. Studiul a fost realizat într-o manieră comparativă, prin determinarea cu ajutorul oximetriei invazive arteriale şi venoase, a dinamicii oxihemoglobinei în diferite stadii ale şocului traumatic pe un lot 30 de bolnavi.
Bine sistematizată, atât în partea generală cât şi în partea personală, lucrarea abordează concis şi precis subiectul. Prezenţa multor scheme, tabele şi grafice color face ca lecturarea să fie facilă, îndeplinind cu prisosinţă condiţiile cerute de o lucrare de diplomă .
Bine fundamentată teoretic - lucrarea are la bază o bibliografie completă şi recentă, selectată şi consultată prin intermediul reţelelor informatice medicale şi al bibliotecilor.
Contribuţia originală a studentului este importantă, fiind realizată atât printr-o documentare aprofundată cât şi printr-o vastă muncă practică (determinări şi studii clinice) efectuate în Secţia de Anestezie şi Terapie Intensivă din Spitalul Judeţean Constanţa.
Sunt de menţionat:
Rezultatele lucrării relevă, pe lângă date ce vin să confirme anumite teorii fiziopatologice şi unele corelaţii ce constituie un preţios instrument de lucru pentru clinicienii ATI. Lucrarea are aşadar atât o valoare euristică cât şi o importantă aplicabilitate practică medicală.
Caracterul inedit al lucrării reiese tocmai din evidenţierea unei corelaţiii semnificative între dinamica oxihemoglobinei şi evoluţia şi prognosticul şocului traumatic, în condiţiile în care date din literatură nu reflectă aspecte concludente în acest sens.
Din considerentele prezentate, precum şi pentru preocuparea şi interesul dovedite pentru partea clinică a studiului, propunem acordarea calificativului maxim acestei lucrări.
Prof. univ. dr. Badiu Gheorghe
Şeful Catedrei de Fiziologie normală şi patologică
a Facultăţii de Medicină - Universitatea "Ovidius" - Constanţa
Mulţumiri:
Îmi exprim profunda recunoştinţă întregului corp profesoral al Facultăţii de Medicină Generală - Constanţa pentru efortul depus în a mă forma ca medic, precum şi cadrelor didactice de la disciplina de fiziopatologie, pentru sprijinul acordat la întocmirea prezentei lucrări.
De asemenea aduc mulţumiri speciale domnului dr. ASAN RUCNI - medic primar ATI - Spitalul Clinic Judeţean - pentru efortul neprecupeţit pe care mi l-a acordat în realizarea părţii practice a acestei lucrări.
Calde mulţumiri catedrei de Informatică Medicală care mi-a pus la îndemână tehnica de calcul necesară pentru tehnoredactarea şi prezentarea acestei lucrări.
Autorul
"Nu prea te gândeşti la boală şi la moarte când eşti încă tănăr şi plin de forţă, dar acest punct de vedere se schimbă după ce ai trăit mult timp în spitale. Încearcă să-ţi reaminteşti privirea acelor bolnavi care poartă pecetea morţii în ochii lor ceţoşi şi lipsiţi de expresie, feţele lor inexpresive, care reflectă indiferenţa totală. Încearcă să ţi-i reaminteşti când vei fi în laborator. Nici nu-şi mai dau măcar osteneala să răspundă la un zâmbet prietenos, consideră că nu mai merită să facă acest efort. Încearcă să-ţi imaginezi latura cea mai îngrozitoare a conştiinţei morţii iminente: umilinţa de a te afla în această situaţie. A fost întotdeauna atât de amuzant pentru ei să anticipeze plăcerile noilor lor paşi şi acum nu mai există alt pas, ci doar o prăpastie, ei vor fi excluşi de la toate eforturile şi luptele vieţii, de la toate pregătirile pentru viitor care conduc în mod normal toate acţiunile noastre. Acum, deodată pentru ei nu mai există viitor. Chinurile durerii cumplite şi umilinţa morţii inexorabile, trece cu buretele peste toate dorinţele noastre. Nimic altceva nu este mai util şi mai plin de satisfacţii ca cercetarea medicală. Chiar măreţia cuceririi Universului, sau groaza că războiul ar putea să izbucnească, toate par să pălească lângă patul unui om bolnav, care va muri din cauză că nu am făcut destule eforturi pentru a afla mai multe despre boala lui."
Hans Selye
Lucrarea tratează un subiect deosebit de interesant din domeniul urgenţelor medico-chirurgicale - şocul traumatic, care rămâne în atenţia cercetării medicale, atât prin incidenţă, gravitate, cât şi prin complexitatea mecanismelor etiopatogenice incomplet elucitate încă.
Studiul dinamicii oxihemoglobinei reprezintă unul din aspectele fiziopatologiei şocului traumatic care suscită interesul deopotrivă al fiziopatologilor şi al clinicienilor, dată fiind relativa sa accesibilitate practică şi valoarea sa în diagnosticul, controlul terapeuticii şi evaluarea prognostică a şocaţilor traumatici.
Complexitatea temei a impus o abordare interdisciplinară, fiziopatologică şi clinică. Studiul a fost realizat într-o manieră comparativă, prin determinarea cu ajutorul oximetriei invazive arteriale şi venoase, a dinamicii oxihemoglobinei în diferite stadii ale şocului traumatic pe un lot 30 de bolnavi.
Sunt de menţionat:
Lucrarea de faţă evidenţiază:
Istoricul evoluţiei conceptului de şoc este legat de progresele cunoştinţelor de fiziologie şi fiziopatologie la nivel de organism, organe, celulă şi molecular-metabolic. Denumirea de şoc provine de la cuvântul englezesc SHOCK sau SHOEKEN (flamand) introdus în literatura medicală prin anii 1795 de către James LATTA şi Henri François LE DRAN, cu înţelesul de lovire (bolnav lovit). John HUNTER şi TRAVERS în 1825 fac primul studiu, caracterizându-l ca stare preagonală şi colaps circulator după o traumă. Nic. I. PIROGOV (1810-1881) îl descrie ca o stupoare traumatică.
Dezvoltarea cunostinţelor asupra şocului de-a lungul istoriei a determinat apariţia de teorii ce privesc mecanismele fiziopatologice ale şocului
[11]:Teoria şocului a evoluat în funcţie de evoluţia explicaţiilor şi teoriilor patogenetice. Pe baza acestor teorii s-a trecut la terapii corespunzătoare.
Între anii 1930-1940, HARRISON clasifica şocul după mecanismele principale generatoare, în :
Observaţii datând de la începutul secolului notează că gradul şocului traumatic apare disproporţionat de mare faţă de estimarea pierderilor sangvine. De aici a derivat ipoteza că ţesuturile lezate eliberează în torentul circulator produşi toxici ce ar fi parţial responsabili de inducerea stării de şoc. Aceste observaţii sunt valabile şi astăzi. Produşii eliberaţi din focarul lezional şi mediatori ai inflamaţiei – eicosanoide, histamina, kininele, serotonina, interleukina 1, TNF şi alţii - sunt constituenţi ai răspunsului organismului la trauma fizică. Ei pot fi incriminaţi în producerea manifestărilor hemodinamice hiperdinamice şi a stării hipermetabolice observate în faza compensată a şocului traumatic [11].
Cu toată abundenţa de date noi asupra fiziopatologiei şocului, pe lângă aprofundarea studiului tulburărilor axului cortico-hipotalamo-hipofizo-suprarenalian, cu cercetarea modificărilor din microcirculaţie şi din spaţiul celular, noţiunea de şoc suscită încă discuţii şi este pe departe de a fi elucidată.
Interpretarea conceptului de "şoc" a suferit de-a lungul timpului numeroase transformări. Dacă la început şocul avea semnificaţia unei stări clinice concretizate prin hipotensiune arterială şi o epuizare funcţională globală a organismului, în prezent se consideră că
şocul este o insuficientă irigare a periferiei (independent de valoarea presiunii arteriale sistemice), având drept consecinţă hipoxia şi acidoza metabolică ca semne de suferinţă celulară [7].O definiţie "atotcuprinzătoare" a şocului este greu de formulat, având în vedere diversitatea aspectelor clinice ale acestuia, a circumstanţelor etiologice, a modalităţilor evolutive şi a terenului pe care survine. S-au formulat o serie de criterii definitorii clinice care înglobează asocierea următoarelor manifestări:
Stările de şoc sunt fenomene biologice în care există leziuni celulare organice multiple determinate prin reacţii nespecifice, neadecvate ale mecanismelor complexe cibernetice ale organismului în vederea păstrării homeostaziei faţă de agresiune.
Stările de şoc sunt rezultatul acţiunii cuplate ale efectelor directe ale factorilor agresori, cu cele ale unor reacţii neadecvate ale sistemului homeostaziei, şi care au tendinţa la autoîntreţinere şi amplificare, nefiind reversibile în lipsa tratamentului.
ETIOLOGIE
Şocul este o stare patologică de amploare şi de durată, instalată ca urmare a unei agresiuni şocogene asupra organismului. În acest conflict dintre factorul şocogen şi organism, ultimul poate fi distrus, sau poate supravieţui prin reechilibrarea spontană sau asistată a funcţiilor sale vitale. Cele două alternative sunt condiţionate de trei factori: agentul agresor generator de şoc, organismul şocat cu toate caracteristicile sale reactive şi elementele de terapeutică.
Agentul agresor produce o leziune asupra organismului. Dacă la început leziunea este localizată şi are particularitatea agentului etiologic, ulterior, prin răsunetul ei sistemic, specificitatea etiologică dispare, iar întregul cortegiu al modificărilor reacţionale capătă o coloratură nespecifică.
Agenţii etiologici au fost împărţiţi de unii autori în 4 grupe
:[9,11]|
Fizico-mecanici: |
Mecanici (traumatisme), termici (combustie, hipertermie),radiaţii ionizante |
|
Chimici: |
Droguri supradozate, diverse substanţe |
|
Biologici: |
Bacterii, virusuri |
|
Psihici: |
Stresul psihic |
Ca să devină şocogeni, aceşti agenţi lezionali
trebuie să aibă o anumită intensitate şi durată de acţiune, pentru a putea atinge "pragul de şoc" (hemoragii peste 25% din volumul sangvin, combustii peste 15%, etc). În funcţie de capacitatea lor şocogenă Moore clasifică agenţii agresori în 3 categorii - stimul nociv, stimul nociv cu potenţial şocogen şi stimul nociv şocogen:|
Anestezie |
Stimul nociv |
|
Arsuri întinse |
Stimul nociv şocogen |
|
Durere |
Stimul nociv |
|
Edem traumatic |
Stimul nociv cu potenţial şocogen |
|
Frică |
Stimul nociv |
|
Frig-cald |
Stimul nociv |
|
Hemodiluţie |
Stimul nociv cu potenţial şocogen |
|
Hemoragie |
Stimul nociv cu potenţial şocogen |
|
Hipercapnie |
Stimul nociv cu potenţial şocogen |
|
Hipoxie |
Stimul nociv cu potenţial şocogen |
|
Imobilizare |
Stimul nociv |
|
Inaniţie |
Stimul nociv |
|
Infecţie |
Stimul nociv şocogen |
|
Necroze întinse |
Stimul nociv şocogen |
|
Oboseală |
Stimul nociv |
|
Oligurie |
Stimul nociv cu potenţial şocogen |
|
Pierderi volemice |
Stimul nociv şocogen |
|
Plasmoragie |
Stimul nociv cu potenţial şocogen |
|
Scăderea fluxului sangvin |
Stimul nociv cu potenţial şocogen |
|
Sindrom de strivire |
Stimul nociv şocogen |
|
Traumă minoră |
Stimul nociv |
|
Traumatism sever |
Stimul nociv şocogen |
Răspunsul organismului la acţiunea agentului şocogen ţine de fapt de reactivitatea acestuia, reactivitate care înglobează factori genetici, nutriţionali, microclimatici, geografici sau sociali, factori imunobiologici (pubertate sau climacteriu), factori legaţi de sex (femeile par mai bine protejate faţă de agresiuni) sau de individ.
[9]În clinică, elementele de terapeutică, încearcă pe de o parte să corecteze leziunile generate de agentul vulnerant iniţial, iar pe de altă parte, să reechilibreze homeostazia organismului şocat.
În contextul traumatismului acut, starea de şoc are o etiologie plurifactorială, factorul comun rămânând însă
hipovolemia, fie prin pierdere sangvină (externă sau ocultă), fie prin transudare lichidiană masivă din compartimentul intravascular în compartimentul extracelular al ţesuturilor traumatizate.În afară de componenta hipovolemică, care este constantă - la bolnavul traumatizat şocul poate avea şi ale cauze, mai mult sau mai puţin evidente, dar care trebuie căutate şi tratate: pneumotoracele sub tensiune, tamponada cardiacă, şocul cardiogen datorat contuziei miocardice sau infarctului şi şocului spinal.
Indiferent de natura leziunilor există modificări fiziologice ce apar la toţi bolnavii sever traumatizaţi, majoritatea acestor modificări afectând, direct sau indirect homeostazia hemodinamică. Aceste alterări fiziologice includ hipovolemia, starea hipermetabolică şi alterarea transportului oxigenului.
Dacă leziunea traumatică nu produce moartea imediată, organismul mobilizează instantaneu o serie de răspunsuri celulare şi neuro-umorale înalt integrate şi organizate în efortul de a stopa hemoragia şi a răspunde necesităţilor crescute de energie ale organismului.
Sinteza hemoglobinei începe în proeritroblast şi continuă câteva zile după ce celulele părăsesc măduva şi trec în circulaţia sangvină.
[17]Un stadiu important este sinteza hemului, care
conţine un atom de fier. Fiecare moleculă de hem se combină cu un lanţ polipeptidic lung (din clasa histonelor) denumit globină.
Astfel se formează o subunitate a hemoglobinei care este lanţul de hemoglobină. Fiecare din aceste lanţuri de hemoglobină are o greutate moleculară de 16000. Patru lanţuri se leagă unul de celălalt pentru ca să formeze o moleculă mare de hemoglobină. Deoarece fiecare lanţ are un grup prostetic, există 4 atomi de fier separaţi în fiecare moleculă de hemoglobină; fiecare din aceşti atomi de fier se poate lega de o moleculă de O2 (deci în total 4 molecule O2 sau 8 atomi de oxigen) care pot fi transportaţi de fiecare moleculă de hemoglobină. Hemoglobina are o greutate moleculară de 64 458. Hemul reprezintă 4%, iar globina 96% din molecula de Hb.[17]
Hb formează 80-90% din reziduul uscat al hematiei, asigurându-i funcţia de transport a gazelor respiratorii şi implicit rolul de "veritabil pulmon molecular".
Globina prezintă variaţii ale secvenţei şi numărului de aminoacizi în funcţie de specie şi pentru aceeaşi specie în funcţie de vârstă.
Globina din hemoglobina normală a adultului (Hb A) este constituită din:
Există la adult o mică proporţie de Hb A2 a cărei globină este formată din 2 lanţuri
a şi 2 lanţuri d .
Hemoglobina fetală (Hb F) prezintă în locul celor 2 lanţuri b , 2 lanţuri g cu altă secvenţă a aminoacizilor şi cu izoleucină în plus faţă de Hb A. La naştere 60-80% din Hb este de tip Hb F, proporţie care diminuează treptat până la 1% la sfârşitul primului an de viaţă; la primate este prezentă de-a lungul întregii vieţi adulte.
Hemoglobinele embrionare (Gower I, Portland, Gower II) pot fi detectate după a 12-a săptămână de gestaţie şi aparţin probabil numai eritrocitelor sacului vitelin.
Hemoglobinele embrionare şi fetale, care diferă de cele adulte prin structura globinei, au proprietăţi fizico-chimice şi funcţionale particulare dintre care cea mai importantă este afinitatea crescută pentru 02.
Structura spaţială a tetramerului Hb normale a fost stabilită cu ajutorul spectrului de difracţie în raze X. Afinitatea pentru O2, legarea labilă a O2, păstrarea Fe în formă redusă de Fe++ (feros) depind de configuraţia spaţială a globinei şi de structura de tetramer a moleculei de Hb.
Hemul este o feroprotoporfirină în care atomul de Fe bivalent realizează şase legături de tip coordinativ. În hemoglobina redusă, Fe++ realizează legăturile coordinative 1-4 cu N inelelor pirolice şi legăturile 5 şi 6 cu azotul inelului imidazolic al histidinei din lanţurile polipeptidice ale globinei. În Hb oxigenată - oxihemoglobina - realizează aceleaşi legături cu excepţia legăturii 6 care se face cu O2 fără oxidarea fierului care rămâne în continuare bivalent.
Compuşii fiziologici ai Hb sunt:
Formarea HbO2 este dependentă de presiunea parţială a O2 (pO2). Fixarea O2 pe primul monomer al Hb determină o modificare în conformaţia spaţială a globinei având ca rezultat o afinitate crescută pentru O2 a monomerului următor. Se realizează o interacţiune "hem-hem" (Perutz, 1970) datorită căreia afinitatea pentru O2 a unui monomer al Hb este condiţionată de oxigenarea monomerului vecin. Astfel relaţia între pO2 şi cantitatea de HbO2 nu este liniară ci se exprimă prin aspectul clasic de " S italic" al curbei de formare-disociere al HbO2.
Afinitatea Hb pentru O2 este condiţionată şi de particularităţile metabolismului eritrocitar. Hb redusă are o structură spaţială care îi permite fixarea acidului 2,3-difosfogliceric (2,3-DPG) rezultat din şuntul Rapaport-Luebering. În prezenţa 2,3-DPG, afinitatea Hb pentru O2 este scăzută. Oxigenarea Hb, modificând conformaţia spaţială a globinei, "expulzează" 2,3-DPG, ceea ce duce la creşterea ulterioară a afinităţii Hb pentru O2.
Oxigenul, difuzat din aerul alveolar, ajunge în sângele venos sub formă de oxihemoglobină, "arterializându-l". O cantitate foarte redusă de O2 se dizolvă în plasmă. În mod normal, aproximativ 97% din oxigen este transportat de la plămâni la ţesuturi combinat chimic cu hemoglobina din globulele roşii [17]. Restul de 3% este transportat în stare dizolvată în apa din plasmă şi din celulele sangvine.
Iată valorile gazelor respiratorii în sânge (ml gaz / 100 ml sânge) (Mountcastle, 1968)
[3]|
|
Combinat chimic |
Dizolvat fizic |
||
|
|
Arterial |
Venos |
Arterial |
Venos |
|
O2 |
20 |
15,2 |
0,3 |
0,12 |
|
CO2 |
46,4 |
50 |
2,62 |
3 |
|
N2 |
0 |
0 |
0,98 |
0,98 |
Aerul atmosferic este format din 20,96% O2, 0,04% CO2 şi 79% azot. Împreună, aceste gaze exercită o presiune atmosferică, adică de 760 mmHg la suprafaţa mării, valoare care include şi presiunea vaporilor de apă (5 mmHg). În parte, fiecare din aceste gaze exercită o presiune proporţională cu procentul lor din aerul atmosferic. Astfel, presiunea parţială a oxigenului în aerul atmosferic este 0,2096 x (760-5) = 158 mmHg, iar presiunea parţială a azotului este 595 mmHg. Prin acelaşi procedeu, pornind de la compoziţia aerului alveolar sau a celui expirat, se calculează şi presiunea parţială a diferitelor gaze din care acestea sunt compuse.
În aerul
alveolar, O2 are o presiune parţială de 103 mmHg, C02 are 40 mmHg şi azotul de 573 mmHg (ceva mai mare decât în aerul expirat). În aerul alveolar, presiunea parţială a vaporilor de apă este de 47 mmHg, la fel ca şi în aerul expirat. În aerul expirat, presiunea parţială a O2 este de 116 mmHg, a CO2 de 28 mmHg, a N2 de 569 mmHg.În aerul expirat, care are o temperatură de 37° C şi este saturat cu vapori de apă, presiunea este tot 47 mmHg. Marea presiune a vaporilor de apă din aerul expirat explică scăderea presiunii parţiale a azotului faţă de cel atmosferic.
Iată presiunile parţiale normale ale gazelor respiratorii la mai multe nivele în organism (mmHg):
|
|
ATM |
EXP |
ALV |
ART |
VEN |
|
O2 |
158 |
116 |
103 |
100 |
37 |
|
CO2 |
0.3 |
28 |
40 |
40 |
46 |
|
N2 |
596.5 |
569 |
573 |
573 |
573 |
|
Vapori H2O |
5.5 |
47 |
47 |
47 |
47 |
|
Presiunea totală |
760.3 |
760 |
763 |
760 |
703 |
Prin urmare, la 37
° C şi o presiune a oxigenului arterial de 100 mmHg, 100 ml plasmă arterială vor conţine numai 0,3 ml O2 sub formă dizolvată. Acesta este conţinutul în oxigen dizolvat al sângelui arterial. În sângele venos acest conţinut rezultă din presiunea parţială a oxigenului care în acest caz este de 37-40 mmHg, fiind de numai 0,13 ml 02 sub formă dizolvată în 100 ml sânge venos.Adăugând sângelui un oxidant care dislocă oxigenul din Hb, se pot extrage 19,5 şi nu 0,3 volume % de oxigen. Cantitatea de oxigen dizolvată fizic este neînsemnată faţă de cea legată chimic.
Aceasta se poate calcula pornind de la faptul că 100 ml sânge conţine 15 g Hb şi că fiecare gram fixează 1,34 ml O2:
Sângele arterial transportă deci de 70 ori mai mult O2 sub formă de HbO2, decât sub formă dizolvată (20:0,3).
Schimburile gazoase dintre aer şi sânge se petrec datorită diferenţelor între presiunile parţiale ale gazelor.
Cantitatea de oxigen consumată într-un minut în repaus de întregul organism este de 250 ml. Acesta este transportat la ţesuturi de sânge, pompat de inimă în circulaţie, în cantitate de 4-5.5 litri/min. Cantitatea de O2 combinată cu Hb este determinată de presiunea lui parţială. Cu cât presiunea parţială a O2 este mai mare cu atât se formează o cantitate mai mare de HbO2.
Dat fiind faptul că o moleculă de Hb conţine patru hemi (Hm) şi că hemul dezoxigenat fixează o moleculă de apă, se poate scrie:
Hm4(H2O) + 4 O2
« 4HmO2 + H2OTeoretic, pe baza calculelor stoichiometrice, un mol de Hb, conţinând 4 moli de Fe, ar trebui să fixeze 4 x 22,4 l O2, ceea ce revine pentru 1 g Hb la 1,38 ml O2, dar în realitate s-a stabilit 1,34 ml O2. Dacă în sânge se găsesc 15 g Hb %, cantitatea de O2, fixată pe Hb conţinută în 100 ml sânge, va fi de 20 ml; această valoare este numită capacitatea de oxigenare a sângelui.
Arătam anterior că, la o saturaţie a Hb cu O2 la 97%, sângele arterial conţine aproximativ 19,4 ml O2 la decilitru. La trecerea prin capilare această cantitate este redusă la 14,4 ml în medie. Rezultă că în condiţii normale fiecare decilitru de sânge cedează la ţesuturi aproximativ 5 ml O2.
Curba raportului dintre hemoglobina redusă şi oxiHb
- în funcţie de presiunea parţială a O2 - are forma unui S italic. La început, cantitatea de oxiHb creşte moderat. Astfel, la PO2 de 10 mmHg, cantitatea de oxiHb este de 10%. La 20 mmHg însă devine 30%, la 30 mmHg ajunge la 60%, apoi curba se îndulceşte, apropiindu-se cu încetul de limita superioară.În mod normal la 27 mmHg se produce o saturaţie a Hb în O2 de 50%. Hb este o enzimă alosterică ce paote fi influenţată de o multitudine de factori:
Efectul Bohr îl putem defini sub două aspecte:
Rolul fiziologic al efectului Bohr este dublu:
La o PO2 arterială de 95 mmHg, fiecare decilitru de apă sangvină conţine aproximativ 0,29 ml oxigen dizolvat fizic. La nivelul capilarelor tisulare unde PO2 sangvin scade la 40 mmHg, mai rămân dizolvaţi numai 0,12 ml O2.
[3]Conţinutul total în O2 al sângelui este determinat de suma dintre:
Fracţiunea de O2 dizolvat fizic în plasmă nu depinde de concentraţia de Hb, ci de PO2 sangvin; în schimb cantitatea de HbO2 depinde în mod clar de concentraţia de Hb în sânge.
Valoarea cantităţii de O2 (DO2, delivery of oxigen) furnizat organismului în timp de un minut este reprezentată de produsul dintre conţinutul în O2 al sângelui arterial (195 ml/L) şi debitul cardiac/minut (5 - 5,5 L); astfel, în mod normal, DO2 este de aproximativ 1L/minut. Ţinând cont de faptul că se consumă aproximativ 45 - 50 ml/L rezultă că întreg organismul consumă, în condiţii fiziologice normale, aproximativ 250-275 ml O2/mL/min, După cum vom vedea acestă valoare este mai scăzută la şocatul traumatic.
Oxigenul este utilizat în permanenţă de către celule.
[17] De aceea PO2 în interiorul celulei este mai scăzut decăt în capilare. În funcţie de distanţa faţă de capilar, PO2 celular variază între 5 - 40 mmHg, cu o medie de 23 mmHg. Dat fiind faptul că PO2 minim necesar pentru satisfacerea deplină a nevoilor metabolice ale celulelor este de numai 1 - 3 mmHg, rezultă că valoarea medie de 23 mmHg este mult decât suficientă şi reprezintă un considerabil factor de siguranţă. Acest fapt ajută în mod considerabil şocatul traumatic, care chiar la valori mici ale diferenţei saturaţiei în O2 arterio-venoase reuşeşte încă să aibă o oxigenare a celulelor organismului.Relaţia dintre PO2 intracelular şi rata utilizării oxigenului
Pentru desfăşurarea normală a metabolismului celular este suficientă o presiune destul de redusă a O2. Sistemul enzimelor respiratorii este astfel adaptat încât el funcţionează la capacitate maximă la PO2 cuprinse între 1 - 3 mmHg. Activitatea enzimatică nu mai creşte la PO2 mai mari. Alftel spus, la PO2 mai mari de 3 mmHg, aprovizionarea cu oxigen a ţesuturilor încetează de a mai fi condiţie limitatoare de rată a activităţii enzimelor respiratorii. În schimb, în aceste condiţii, principalul factor limitativ de rată devine concentraţia de adenozin-difosfat (ADP) din celule. Acest efect este reflectat de relaţia dintre PO2 intracelular şi rata utilizării O2.
Este interesant de remarcat că ori de câte ori PO2 depăşeşte valoarea de 1 - 3 mmHg, rata utilizării oxigenului devine constantă la oricare din concentraţiile de ADP din celulă. Pe de altă parte, atunci când variază concentraţia ADP, rata utilizării oxigenului variază proporţional cu variaţia concentraţiei ADP. Când ATP este utilizat în celulă ca sursă de energie, el este convertit în ADP. Creşterea concentraţiei
de ADP determină la rândul ei, creşterea utilizării oxigenului şi a celorlalţi compuşi nutritivi care se combină cu O2 pentru a se elibera energie. Această energie este folosită pentru refacerea ATP. De aceea,
în condiţii normale, rata utilizării oxigenului la nivel celular este controlată, în final, de rata eliberării de energie în celulă, adică de rata formării ADP din ATP. Disponibilitarea de O2 devine un factor limitant numai în condiţii anormale de hipoxie, aşa cum este cazul şocatului traumatic.În cazurile de anoxie se poate asigura aportul de oxigen prin oxigenoterapie. Presiunea parţială a O2 în aerul atmosferic este de 158 mmHg, Raportând-o la presiunea totală atmosferică de 760 mmHg, obţinem o valoare de 4,81. Prin urmare, atunci când se respiră O2 pur, concentraţia acestuia la presiunea de 760 mmHg este de 4,81 ori mai mare decât în aerul atmosferic. Conform legilor de solubilizare ale gazelor, la această presiune, în loc de 0,3 ml O2 dizolvat în 100 ml plasmă, se vor dizolva de 4,81 ori mai mult, adică 1,443 ml O2 la 100 ml plasmă. Aceasta va însemna o mărire a aprovizionării ţesuturilor cu O2.
|
|
Respirare de aer |
Respirare de O2 pur |
||||
|
PO2 în aer (mmHg) |
PCO2 în alveolă (mmHg) |
PO2 în alveolă (mmHg) |
Saturaţia în O2 a sângelui arterial (%) |
PCO2 în alveole (mmHg) |
PO2 în alveole (mmHg) |
Saturaţia în O2 a sângelui arterial (%) |
|
158 |
40 |
103 |
97 |
40 |
673 |
100 |
Conceptele de transport şi aport de O2 sunt bazate pe lucrările lui Barcroft care a înteles că circulaţia sângelui este un sistem de transport al O2 ce depinde de:
[25]El a clasificat deficitele în O2 ale sistemului circulator în:
Barcroft demostrează că măsurarea izolată a conţinutului în O2 al sângelui arterial are o foarte mică importanţa în evaluarea deficitului de O2 la nivel tisular. O diminuare a aportului de O2 este adesea greu de recunoscut căci organismul distribuie rapid cantitatea de care este nevoie către ariile vitale. Unul din efectele imediate ale hipoxiei este creşterea tonusului simpatic cu eliberarea de hormoni simpatomimetici ce vor determina arteriolo-constricţie în ţesuturile cu inervaţie simpatică bogată. Astfel, pielea, muşchiul în repaus şi regiunea spanhnică vor avea un flux sangvin diminuat în timp ce coronarele vor primi mai mult sânge.
Aportul inadecvat de O2 poate fi evaluat prin compararea presiunii transcutanate a O2 (Ptc O2) cu PaO2. O Ptc O2 mică înseamnă că furnizarea de O2 este convertită de la piele către alte ţesuturi.
Debitul cardiac şi volumul ventilator pe minut pot creşte ceea ce va tinde să mărească oxigenarea sângelui la nivel pulmonar. Mai târziu o descreştere a afinităţii oxihemoglobinei datorată acidozei şi o creştere a concentraţiei eritrocitare a 2,3-DPG vor spori capacitatea de oxigenare a ţesuturilor.
Dacă pacientul devine hipoxic pentru că există o marcată diminuare a conţinutului arterial în O2 (CaO2), cele mai multe ţesuturi vor continua să funcţioneze la o presiune a O2 scăzută. Nivelul utilizării O2 variază seminificativ între ţesuturi. Inima consumă mult O2, în mod normal extragând aproximativ 11 mL O2/dL, ceea ce reprezintă 50% din O2 -ul furnizat coronarelor. În condiţii de repaus ale organismului, inima este perfuzată de aproximativ 5% din debitul cardiac - dar consumă 10% din O2-ul furnizat organismului. Singurele modalităţi prin care inima poate face faţă situaţiei în care PaO2 scade, sunt: creşterea fluxului sangvin prin coronare, vasoconstricţia periferică, scăderea afinităţii Hb pentru O2.
Creierul necesită mai puţin O2, în mod normal consumând 8 mL /dL.
Datele obţinute din măsurarea gazelor sangvine pot fi folositoare în conduita terapiei pacienţilor în stare de şoc şi în aprecierea evoluţiei cazurilor respective.
Totuşi nu orice pacient şocat necesită de a fi monitorizat folosind asemenea tehnici sofisticate, şi chiar însăşi această tehnică nu asigură o evaluare ideală a oxigenării tuturor ţesuturilor organismului.
[6] Acelaşi lucru s-ar putea spune despre măsurarea seriată a nivelului de lactat (ser lactat), metodă folosită de unii medici pentru monitorizarea bolnavilor în stare critică.Recent, măsurându-se pH-ul intramucos gastric cu ajutorul unui tonometru situat în stomac, care măsoară PC02 intraluminal, a fost propusă o metodă de estimare a oxigenării tisulare a acestui organ şi prin inferenţă, a întregului organism. Măsurarea pH-ului intramucos gastric s-a demostrat de a fi o metodă mai precisă decât nivelurile lactatului sau a altor variabile folosite în predicţia evoluţiei cazurilor de insuficienţă circulatorie. Cu toate acestea, se pare că evaluarea oxigenării ţesuturilor se realizează cel mai bine prin analiza individuală a fiecărui organ în parte, prin metode biochimice, folosindu-se indici renali şi hepatici, măsurarea diurezei şi observarea statusului mental.
ELEMENTE DE FIZIOPATOLOGIE ALE ŞOCULUI TRAUMATIC
Înţelegerea actuală a noţiunii de şoc se bazează pe o concepţie unitară "neuro-endocrino-vasculo-celulară" (Moore, Chiricuţă, Gelin, Laborit, Teodorescu-Exarcu, Mandache, Şuteu), în sensul că şocul provoacă o reacţie sistemică atât de intensă încât produce o tulburare severă hemodinamică şi metabolică. Stările de şoc sunt fenomene biologice în care există leziuni celulare organice multiple determinate prin reacţii nespecifice, neadecvate ale mecanismelor complexe cibernetice ale organismului în vederea păstrării homeostaziei faţă de agresiune.
[9]Elementul ce caracterizează şocul este hipoxia tisulară. În şoc apare acidoză intracelulară prin acumulare de lactat, legată de trecerea de la glicoliza aerobă la cea de tip anaerob, cu un comportament endocrin deosebit (hipersecreţie de ADH, aldosteron, renină, catecolamine şi alte substanţe vasoactive); alţi autori consideră şocul ca o perturbare profundă a sistemelor enzimatice intracelulare, în special în sânul aparatului mitocondrial.
Şocul este caracterizat iniţial prin hiperactivitate simpatică, desfăşurându-se într-un sistem de 3 etaje: etajul sistemului de comandă şi control neuroendocrin, etajul sistemului hemodinamic central şi periferic, cu diminuarea perfuziei tisulare şi etajul celular organic.
[2]Stările de şoc sunt rezultatul acţiunii cuplate ale efectelor directe ale factorilor agresori, cu cele ale unor reacţii neadecvate ale sistemului homeostaziei, şi care au tendinţa la autoîntreţinere şi amplificare, nefiind reversibile în lipsa tratamentului.
Homeostazia se realizează prin mecanisme complexe interdependente în vederea menţinerii organismului în limitele constantelor fiziologice; organismul se adaptatează la solicitările care tind să dezechilibreze funcţiile normale ale sistemelor şi organelor. Reacţiile organismului la agresiune, în vederea păstrării homeostaziei, se împart în trei categorii:
Stările de şoc se caracterizează prin:[11]
K
Starea de şoc se poate defini drept o alterare a posibilităţilor de aport de oxigen la nivel tisular (prin scăderea performanţelor cardiace - stare hipodinamică) cât şi a capacităţii celulare de utilizare a oxigenului şi a substratului energetic.Microcirculaţia este cel mai important sector vascular, din punct de vedere al schimburilor metabolice.
ŞT este iniţial cauzat de pierderi lichidiene (sânge şi plasmă) atât intra- cât şi extracorporeal
[30]. Pierderile lichidiene sunt agravate şi de faptul că extravazarea plasmatică are loc în ţesuturi plasate la distanţă de ariile traumatizate.Extravazarea apare ca un răspuns inflamator sistemic generalizat ce este generat de eliberarea mediatorilor inflamaţiei din ţesuturile lezate când acestea sunt reperfuzate în timpul resuscitării - factorul XIIa acţionează asupra complementului, kininelor şi tromboxanilor; mai mult, ţesutul lezat mobilizează şi activează leucocitele şi trombocitele (cu eliberare de TNF), interleukina I, radicalii oxizi, leucotrienele, kininele, serotonina şi histamina. Ca urmare apare o creştere generalizată a permeabilităţii vasculare sistemice cu pierdere de plasmă în ţesutul interstiţial şi agravarea unei eventuale hipovolemii preexistente.
Consecinţele majore ale unui şoc traumatic nu se resimt decât după 24-48h ce urmează traumatismului deoarece inflamaţia şi ulterior hipermeabilitatea vasculară (datorată inflamaţiei) apar treptat, pe parcursul mai multor ore. Iniţial, PVC oferă indicii suficiente pentru terapia ce vizează menţinerea patului vascular. Ulterior microvascularizaţia pulmonară devine blocată de mici particule rezultate în urma procesului de CID; în acelaşi timp apare şi o vasoconstricţie generalizată ca răspuns la substanţele vasoactive eliberate în circulaţie; ca urmare apare o insuficienţă ventriculară dreaptă. De aceea, principiile iniţiale de resuscitare vor fi guvernate de raţionamente fiziologice - obiectivul principal fiind restabilirea aportului adecvat de oxigen către organele vitale; eforturile de a îmbunătăţii condiţia sistemului circulator vor fi fără rezultat, atâta timp cât pO2 în sângele circulant nu este suficientă şi de aceea asigurarea funcţiilor respiratorii şi circulatorii este primul lucru ce trebuie făcut.
Modificări fiziopatologice compensatorii apărute în contextul şocului traumaticModificarea fiziopatologică primară este reducerea volemiei, o constantă homeostazică deosebit de importantă pentru supravieţuire. Un individ poate supravieţui cu 15% din funcţia normală a ficatului, 25% din funcţia normală a rinichilor, 35% din numărul total de hematii, 45% din suprafaţa de hematoză pulmonară, dar are nevoie de 70% din volumul plasmatic. Reducerea volemiei cu mai mult de 30% este critică pentru supravieţuire.
Scăderea cu peste 25% a volemiei declanşează mecanisme compensatorii hemodinamice iniţiate de o reacţie neuro-endocrină. Într-o primă fază, catabolică, se produce activarea sistemului nervos simpatic cu eliberare de catecolamine în exces. Este o reacţie imediată produsă de stimularea presoceptorilor din sinusul carotidian, arcul aortic şi vasele splanhnice, la care se asociază reflexul declanşant de hipovolemie prin stimularea receptorilor din atriul drept
[12]. Semnalele sunt transmise la scoarţă şi centrii diencefalici (hipotalamulsul posterior - sediul centrilor vegetativi simpatici) care declanşează un răspuns simpato-adrenergic, susţinut ulterior de un răspuns neuro-endocrin.[20]|
Pierderi sangvine |
sub 15% (sub 750 ml) |
15 – 20% (750ml - 1,5L) |
30 – 40% (1,5L - 2L) |
Peste 40% (2L) |
|
Frecvenţa cardiacă |
sub 100 |
sub 100 |
peste 120 |
Peste 140 |
|
Tensiunea arterială |
Normală |
Normală |
Scăzută |
Scăzută |
|
Presiunea pulsului |
Normală |
Scăzută |
Scăzută |
Scăzută |
|
Puls capilar |
Normal |
Scăzut |
Scăzut |
Scăzut |
|
Frecvenţa respiratorie |
14 - 20 |
20 – 30 |
30 - 40 |
Peste 35 |
|
Diureza (ml/h) |
sub 30 |
20 – 30 |
5 - 15 |
Minimă |
|
Starea mentală |
uşoară anxietate |
anxietate |
anxietate confuzie |
Confuzie letargie |
Există şi posibilitatea unui răspuns vagal declanşat de o stimulare brutală, răspuns ce poate declanşa bradicardie până chiar la oprirea cordului.
Activarea sistemului nervos simpatic determină:
[18, 19, 20]În hipotensiunea severă, nivelul circulant de adrenalină atinge 2-4
m g/mL şi cel de noradrenalină 6-8 m g/mL. Sub acţiunea catecolaminelor debitul cardiac este refăcut parţial prin:Creşterea tonusului simpatic şi nivelul crescut al catecolaminelor circulante determină constricţia arteriolelor şi venulelor bogate în receptori
a adrenergici din tegument, musculatură şi unele viscere. Reducerea distribuţiei sângelui în aceste teritorii permite mobilizarea unei mase de sânge spre cord şi creier, teritorii în care vasoconstricţia simpato-adrenergică nu are loc, deoarece vasele coronariene şi cerebrale sunt lipsite de a receptori. La refacerea volumului circulant în teritoriul organelor vitale contribuie în special la mobilizarea sângelui din sectoarele splanhnic şi papilar din derm, prin vasoconstricţie.Pentru restabilirea TA în şoc alături de hipertonia simpato-adrenergică intervine activarea sistemului renină-angiotensină şi eliberarea de arginin-vasopresină. Afectarea barostatului renal reprezentat de receptorii din arteriola aferentă declanşează eliberarea de renină, care generează angiotensină I, transformată în angiotensină II. Aceasta din urmă reface TA prin creşterea tonusului vasomotor arteriolar în patul mezenteric şi contribuie la eliberarea de catecolamine din medulo-suprarenală. În plus, creşte eliberarea de aldosteron din cortexul suprarenal, provocând retenţia de Na+ şi apă.
Cel de-al treilea sistem presor care intervine compensator este eliberarea de vasopresină din hipofiza posterioară declanşată de stimularea receptorilor de întindere din cord, vasopresină ce va creşte rezistenţa vasculară în teritoriul splanhnic.
Vasoconstricţia catecolaminică, care interesează arteriola, meta-arteriola şi sfincterele capilare afectează deplasarea lichidelor între compartimentul intravascular şi cel interstiţial, în baza ecuaţiei lui Starling
[28]:Q = Kf (Pc - Pi) -
s (p c - p i),în care:
Q = fluxul (volum/unitate de timp) prin peretele capilar
Kf = coeficientul de filtrare al peretelui capilar
Pc = presiunea hidrostatică capilară
Pi = presiunea hidrostatică a lichidului interstiţial
p
c = presiunea coloid osmotică capilarăp
i = presiunea coloid osmotică a lichidului interstiţials
= coeficientul osmotic de refracţie al proteinelor plasmatice. (ex. s = 1 dacă peretele capilar este impermeabil la coloizi şi s = 0 dacă membrana capilară este complet permeabilă la coloizi).Vasocontricţia precapilară reduce presiunea hidrostatică capilară, favorizând transferul lichidelor din interstiţiu spre compartimentul vascular. În plus modificările metabolice declanşate de eliberarea de catecolamine (glicogenoliza) vor elibera glucoza şi alţi produşi de glicoliză în compartimentul interstiţial şi vor favoriza creşterea volumului şi presiunii la acest nivel prin atragerea apei celulare. Presiunea interstiţială crescută va contribui la restabilirea volumului intravascular. Acest mecanism al reumplerii transcapilare reprezintă un mecanism compensator important în faza iniţială a şocului hipovolemic.
Într-o fază ulterioară, organismul lansează pentru compensare mecanisme exclusiv endocrine, cu desfăşurare mai lentă şi prelungită. Este reacţia ACTH - cortizolică completată cu acţiunea hormonilor tiroidieni şi retrohipofizari. Declanşarea reacţiei este atribuită creşterii osmolarităţii prin retenţia de sodiu. Stimularea osmoreceptorilor produce pe cale hipotalamo-hipofizară (nucleii supraoptici şi paraventriculari) eliberarea de ADH, care, prin acţiunea sa la nivelul tubului contort distal, tinde să refacă volumul lichidului extracelular, iar pe de altă parte stimulează secreţia de ACTH care, acţionând asupra corticosuprarenalei determină hipersecreţie de cortizol. Reacţia ACTH - cortizolică contribuie la reţinerea de Na şi apă şi tinde să refacă rezervele glucidice epuizate sub acţiunea catecolaminelor prin gluconeogeneză pe seama proteinelor.
Dacă nu se intervine terapeutic şi hipovolemia persistă, reducerea prelungită a perfuziei tisulare diminuă transportul de oxigen la ţesuturi. La început, consumul de O2 este menţinut prin creşterea extracţiei de O2, dar curând acest mecanism compensator devine insuficient şi se instalează hipoxia tisulară asociată cu acidoză lactică şi scăderea depozitelor de fosfat macroergic (ATP).
Hipoxia şi acidoza produc tulburări grave ale activităţii celulare şi ale peretului microvasului. Datorită acumulării de metaboliţi, răspunsul microcirculaţiei la catecolaminele endogene scade şi progresiv
capilarele se deschid, sfincterele precapilare, metaarteriolele şi chiar arteriolele se dilată. Se deschide astfel un pat vascular imens care preia o parte din sângele circulant, accentuând hipovolemia. Venele, mai rezistente la hipoxie şi acidoză, rămân mai mult timp contractate. Ca urmare, sângele din patul vascular dilatat stagnează, întoarcera venoasă diminuă şi debitul cardiac se reduce şi mai mult.Mai multe mecanisme contribuie la decompensarea circulaţiei periferice:
Un alt mecanism care contribuie la decompensarea vasculară în şoc este eliberarea de opioizi endogeni, care reduc răspunsul simpatic din centrii nervoşi centrali. De obicei, eliberarea de b -endorfine începe după ce s-a pierdut 1/4 din volumul sangvin (1250 ml / 70 Kg). Ulterior, insuficienţa microcirculaţiei este agravată de creşterea permeabilităţii capilare, obstrucţiei capilarelor cu agregate plachetare şi hemo-leucocitare, edemul celulelor endoteliale.
Două mecanisme participă la creşterea permeabilităţii microvasculare în fazele avansate ale şocului:
Încetinirea fluxului sangvin până la stază capilară, blocarea capilarelor cu agregate de leucocite activate şi trombocite, scăderea capacităţii de deformare a eritrocitelor, scăderea titrului de heparină prin inhibiţia sistemului reticulo-histiocitar sunt factorii care creează premizele unui fenomen specific şocului ireversibil: coagularea intravasculară diseminată cu microtrombozare şi diateză hemoragică [29]
Decompensarea microcirculaţiei reduce şi mai mult întoarcerea venoasă şi debitul cardiac iar tensiunea arterială se prăbuşeşte sub valorile critice de asigurare a irigaţiei organelor vitale. Staza capilară, acidoza şi trombozele capilare realizează un cerc vicios, care, necorectat la timp conduce la instalarea leziunilor celulare hipoxice ireversibile.
Edemul reticulului endoplasmatic este prima leziune ultrastructurală hipoxică, urmată de afectarea mitocondriei, cu condensarea compartimentului intern şi edemaţiere progresivă. Persistenţa hipoxiei celulare determină ruptura lizozomilor şi eliberarea enzimelor proteolitice, care produc digestie intracelulară şi depunere de calciu intracelular. Este momentul instalării leziunilor celulare ireversibile, care corespunde ireversibilităţii pe plan clinic. Suferinţa celulei aduce în plan clinic simptomatologia insuficienţelor de organ. În cazul şocului hipovolemic, aceasta se manifestă târziu şi organul cel mai afectat este rinichiul. Cauza insuficienţei renale acute este hipoperfuzia renală. Hipertonia simpatică, catecolaminele circulante, angiotensina şi vasopresina produc vasoconstricţia arteriolei aferente şi redistribuţia fluxulului sangvin renal de la corticală spre nefronii medulari. Ca urmare, scade filtratul glomerular. În paralel, sub acţiunea aldosteronului şi ADH, creşte reabsorbţia lichidului tubular. Reducerea filtrării glomerulare şi resorbţia tubulară crescută produc oliguria, manifestare clinică caracteristică a şocului hipovolemic. Persistenţa hipoperfuziei renale conduce la necroza celulelor tubulare, iar coagularea intravasculară diseminată (CID) accentuează scăderea filtrării glomerulare. Insuficienţa renală acută capătă un substrat lezional, organic. Vasoconstricţia din teritoriul splanhnic determină suferinţa ischemică a ficatului, pancreasului şi tractului gastrointestinal care perpetuează şocul. Substanţele eliberate din aceste organe contribuie la debutul ireversibilităţii şocului.Tabloul clinic exprimă tulburarea hemodinamică şi suferinţa viscerală din şoc, la care se pot asocia semne ce evidenţiază afecţiunea cauzală care a produs şocul.
Hipotensiunea arterială se asociază de tahicardie, polipnee, extremităţi reci, cianotice, cu absenţa pulsului capilar, oligurie. Presiunea venoasă centrală este scăzută indicând reducerea presarcinii. Presiunea capilară pulmonară este redusă, debitul cardiac fiind scăzut.
Creşterea rezistenţei vasculare periferice prin vasoconstricţie este obiectivată de valorile crescute ale gradientului de temperatură centrală/periferică.Suferinţa viscerală survine tardiv şi interesează în principal funcţia rinichiului. O vasoconstricţie severă sau prelungită determină instalarea insuficienţei renale acute, prin reducerea filtrării glomerulare, urmate de tubulonecroză
[26]. Datorită "centralizării" circulaţiei, funcţia plămânului nu este afectată şi PaO2 se menţine în limite normale. Hiperventilaţia ce survine precoce în şocul hipovolemic este produsă de stimularea chemoreceptorilor periferici şi mai târziu, de acidoza metabolică. Starea de conştienţă se alterează progresiv (obnubilare, confuzie).1. stadiul iniţial (şoc neevolutiv, şoc compensat, etapa reacţiei nespecifice de apărare) este caracterizat printr-o reducere moderată a debitului cardiac, secundară scăderii întoarcerii venoase, pierderii de lichide sau datorită efectului inotrop negativ asupra inimii
[8]. În general reflexele compensatorii menţin presiunea sangvină la valori normale sau uşor scăzută. Reflexele compensatorii vor conduce la:2. Cel de-al doilea stadiu al şocului (etapa de stare de şoc) are loc la o pierdere de 15-25% din volumul sangvin. Acest stadiu se caracterizează printr-o intensă vasoconstricţie arteriolară. Deoarece debitul cardiac este relativ scăzut vasoconstricţia arteriolară nu va putea în mod practic să menţină presiunea sangvină la valori normale.
3. În al treilea stadiu al şocului - pierderi mici adiţionale de volum sangvin sau alterări ale funcţiei cardiace vor produce o rapidă deteriorare a circulaţiei sangvine şi în consecinţă va apare o irigare insuficientă a ţesuturilor organismului. Dacă această stare persistă se vor produce (datorită hipoxiei, acumulării de metaboliţi şi substanţe ale reacţiei inflamatorii) leziuni tisulare întinse (etapa insuficienţelor multiple de organe şi sisteme - MSOF). Acest stadiu progresează rapid către stadiul de şoc ireversibil care este fatal.
Urmărirea în evoluţie a schemelor hemodinamice din stările de şoc, a permis să se constate diferenţe semnificative între parametrii schemelor supravieţuitorilor, faţă de cele ale cazurilor care nu supravieţuiesc. Astfel, componentele compensatorii ale supravieţuitorilor sunt mult mai mari faţă de cele ale nesupravieţuitorilor. Fluxul, volumul şi consumul O2 (VO2) sunt parametrii predictivi în evoluţia stărilor de şoc.
Diagnosticul şocului vizează prezenţa a trei componente implicate în şoc: hipotensiunea, disfuncţiile de organe şi perfuzia tisulară diminuată.
TAM = TAD + (TAS - TAD)/3
oligurie, dispnee, ischemie miocardică, tulburări mentale.
Indexul de şoc Allgöwer
= P/TAS;unde P = puls şi TAS = tensiunea arterială sistolică;
Deci, diagnosticul se pune pe baza:
Aceste mecanisme acţionează
în secunde sau minute şi sunt, aproape în întregime, reflexe nervoase acute sau alte răspunsuri nervoase. Există trei mecanisme ce răspund în câteva secunde:Acestea nu numai că încep să reacţioneze în câteva secunde, dar sunt şi foarte puternice. După prăbuşirea acută a presiunii arteriale din cursul şocului traumatic - mecanismele nervoase se combină pentru a determina venoconstricţie, ce are ca urmare creşterea întoarcerii venoase, creşterea frecvenţei şi a contractibilităţii cardiace şi arteriolo-constricţie pentru a împiedica scurgerea sângelui din artere. Toate aceste efecte apar aproape instantaneu pentru a susţine presiunea arterială la un nivel compatibil cu viaţa.
După alte câteva minute
există alte trei mecanisme de intervenţie:Aceste trei mecanisme devin operative total în aproximativ 30 minute până la câteva ore. Efectul lor poate dura mai mult, zile dacă este necesar. Concomitent, mecanismele nervoase se epuizează şi devin din ce în ce mai puţin efective, ceea ce explică importanţa acestor mecanisme de control pe termen mediu a presiunii arteriale.
Rinichii intervin în reglarea pe termen lung a presiunii arteriale. Acest mecanism necesită câteva ore pentru a deveni evident şi reprezintă un control feedback cu o eficienţă şi putere mare.
Prin urmare, controlul presiunii arteriale începe cu măsurile vitale luate de mecanismele nervoase, apoi continuă cu cele caracteristice sistemelor de control pe termen mediu şi în final presiunea arterială este stabilizată pe termen lung, la un anumit nivel de către mecanismul rinichi-lichidele extracelulare. Acest mecanism are interacţiuni multiple cu sistemul renină-angiotensină-aldosteron şi cu sistemul nervos.
Efectul protector al reflexelor asupra debitului coronarian şi cerebral
O valoare deosebită în menţinerea presiunii arteriale normale, în situaţia scăderii debitului cardiac, o are protejarea debitului coronarian şi a debitului cerebral. Stimularea simpatică nu determină vasoconstricţie semnificativă pe vasele cerebrale şi coronare. În plus, în ambele paturi vasculare intervine şi autoreglarea locală, care împiedică afectarea debitelor locale de sânge în scăderile moderate ale presiunii arteriale.De aceea,
debitul de sânge prin inimă şi creier este menţinut la valori normale atâta timp cât presiunea arterială nu scade sub 70 mmHg, în ciuda faptului că în multe alte zone ale organismului debitul sângelui poate să scadă la un sfert din valoarea normală datorită vasospasmului.Şocul evolutiv - cercul vicios al deteriorării cardiovasculare
O dată ce şocul a ajuns în stare severă, încep să se deterioreze chiar structurile sistemului circulator, apărând diverse tipuri de feedback pozitiv care determină un cerc vicios al scăderilor progresive a debitului cardiac. Cele mai importante dintre aceste mecanisme de feedback pozitiv sunt următoarele:
Iată câteva din efectele ce apar în urma deteriorării celulare:
Este evident că toate aceste efecte vor contribui la deteriorarea în continuare a diferitelor organe, în special:
Într-un anumit stadiu de evoluţie al şocului orice atitudine terapeutică devine incapabilă de a salva viaţa persoanei respective. De aceea se numeşte stadiul ireversibil al şocului. Chiar şi în acest stadiu ireversibil, terapia poate uneori să readucă presiunea arterială şi chiar debitul cardiac la normal pentru scurte perioade de timp. Totuşi sistemul circulator continuă să se deterioreze şi decesul apare după câteva minute sau ore. Motivul pentru care se întâmplă acest lucru este că s-au produs prea multe leziuni tisulare, au fost eliberate prea multe enzime distructive în lichidele organismului şi acţionează prea mulţi factori distructivi încât chiar şi revenirea la normal a debitului cardiac nu poate împiedica continuarea deteriorării. Aşadar, în şocul sever se ajunge la stadiul în care pacientul va muri chiar dacă prin diverse metode terapeutice debitul cardiac este readus la normal pentru scurte perioade de timp.
EFECTUL ŞOCULUI TRAUMATIC ASUPRA ÎNTREGULUI ORGANISM
În toate tipurile de şoc, aportul de oxigen şi substanţe nutritive la ţesuturi este insuficient. În urma acestui fapt se reduce metabolismul celular, cu:
Este evident că toate aceste efecte duc la deteriorări celulare şi în final la scăderea metabolismului general. În mod normal, o persoană poate trăi doar câteva ore dacă debitul cardiac scade la 40% din valoarea normală.
Câteva dintre efectele generale produse în organism sunt:
În cazul ŞT, după constituirea la nivelul traumatismului a reacţiei inflamatorii specifice determinată de distrugerile mecanice ale celulelor şi vaselor sangvine - apare o discrepanţă între performanţele macrocirculaţiei (unde a intervenit masiv sistemul catecolaminic) şi microcirculaţie, unde apar fenomene de şuntaj periferic şi maldistribuţii, datorită unui important edem interstiţial, agregare trombocitară şi CID. Se constată o creştere a saturaţiei cu O2 a sângelui venos, dovedind o extracţie diminuată de O2 din partea ţesuturilor şi o incapacitate celulară de a utiliza oxigenul, deşi oferta de O2 rămâne practic neschimbată. Acest fapt indică aparaţia deja a leziunilor celulare ireversibile.
Se produc prin hipoxia care determină oprirea metabolismului aerob, a producţiei ATP şi oprirea tuturor mecanismelor metabolice dependente de ATP, a activităţii sistemelor enzimatice şi a pompelor ionice, precum şi a sintezei proteice. Pe de altă parte, se produce acumularea de metaboliţi intermediari şi finali ai lanţurilor metabolice, cu acidoză metabolică şi hipo-osmolaritate intracelulară. Creşte permeabilitatea membranei şi a organitelor, în special a mitocondriilor; apa, Na+ şi Ca++, pătrund în interiorul celulelor şi al organitelor determinând intumescenţe.
Calciul este eliberat din depozitele mitocondriale în citosol, activează enzimele ATP-azice şi sistemele metabolice ale celulei, consumând rapid ultimele rezerve de ATP. Dezorganizarea structurală a mitocondriilor (văzută stadial la microscopul electronic), trece prin mai multe faze - iar ireversibilitatea apare atunci când se observă leziuni ale crestelor mitocondriale şi în final când apare explozia mitocondrială.
Leziunea ischemică este progresivă până la moartea celulară, relativ lent şi variabil, de la ţesut la ţesut (în câteva minute la creier şi miocard, zile la tegumente).
Apar în toate zonele ischemiate şi/sau traumatizate. La scurt timp de la agresiune, factorii chemotactici, generaţi de mastocite, vor aglomera elementele celulare ale imunităţii non-specifice, macrofage şi polinucleare neutrofile (PMN) la locul distrucţiei tisulare. Rolul lor este de a remania leziunea prin îndepărtarea componentelor străine şi a resturilor tisulare, pregătind deci cicatrizarea. Macrofagele şi leucocitele active dezvoltă rapid capacitatea litică tisulară prin geneza de superoxizi şi de proteaze active. Superoxizii generează acid hipocloros (în contactul cu mediul bogat în NaCl), acesta având capacitatea de a neutraliza antiproteazele tisulare şi umorale din regiunea lezată; astfel, aceste proteaze acţionează şi distrug elementele străine sau autohtone. În afara acestui mecanism, distructiv în esenţă, se produce şi un mare număr de mediatori tisulari necesari activării celulelor ce iau parte la procesele inflamatorii, creează de asemenea condiţii locale vasodilatatorii şi pentru neoformaţie vasculară. Dintre aceşti mediatori sunt de menţionat interleukinele, interferonul, prostaglandinele, leucotrienele, tromboxanii, derivaţi ai inozitol-fosfaţilor, TNF, citokine.
Când fenomenul inflamator rămâne cantonat la leziune, nu se resimt la distanţă decât efectele mediatorilor: apar febra, sindromul hiperdinamic, efecte hipermetabolizante şi catabolizante proteice.
Dacă bariera din jurul leziunilor inflamatoare este distrusă sau focarele au o mare amploare, mediatorii stimulanţi şi activatori ai leucocitelor se vor răspândi în organism creând focare inflamatorii secundare în diverse organe, sindrom de răspuns inflamator cu apariţia insuficienţelor multiple de organe şi sisteme.
Apariţia focarelor inflamatorii secundare poate avea loc şi prin acţiunea complementului activat pe cale directă sau alternă, prin endotoxine, complexe imune sau compuşi chimici, realizând leziuni foarte grave de tip apoplectic, datorate leziunilor capilare care sunt induse precoce şi apoi însoţite de fenomenele decompensării hemodinamice acute - colaps.
Apar în ţesuturile care au stat în stare de ischemie un timp variabil, însă nedepăşind faza de ireversibilitate, sunt expuse pe parcursul reperfuzării cu sânge, efect datorat eficienţei măsurilor terapeutice efectuate. Acum, alături de fenomenele locale (edem, rigiditate) vor apare fenomene generale (instabilitate hemodinamică, instalarea insuficienţelor de organ: renală, hepatică, pulmonară, pareză digestivă, etc.). Aceste fenomene sunt generate în ţesuturile reperfuzate de prezenţa radicalilor de O2, produşi prin acţiunea xantinei asupra O2, sosit prin reperfuzare. Xantina apare prin degradarea intensă a ATP (ATP
® ADP ® AMP ® adenină ® hipoxantină ® xantină). Radicalii de O2 oxidează acizii graşi ai fosfolipidelor membranare celulare alterându-se astfel structura acestora, generând un focar inflamator la început aseptic şi mai apoi septic; are loc o diseminare generală a deşeurilor şi mediatorilor celulari, determinându-se leziuni organice la distanţă.Măsurile de deşocare refac fluxurile sangvine şi implicit determină leziuni de reperfuzare, care apoi evoluează pe cont propriu, independent de cauza iniţială declanşantă.
Prognosticul bolnavilor şocaţi nu depinde atât de leziunea determinantă, cât de fenomenele de reperfuzare, care scurtează marcat timpul de recuperare (pentru creier de la 40 - 60 minute, dacă ar fi numai timpul ischemic, la 3 - 5 minute datorită reperfuzării; pentru miocard de la 1 - 2 h la câteva minute). Fenomenele de reperfuzie stau la baza apariţiei sindromului de insuficienţă multiplă de organe, consecinţa cea mai frecventă fiind insuficienţă renală.
Distrucţiile tisulare activează aderarea şi agregarea trombocitară şi a cascadei coagulării, determină eliberarea de factori vasoconstrictori locali având ca rezultat formarea trombilor fibrino-plachetari cu rol în stoparea hemoragiei din focarul lezional. Eliberarea de histamină, heparină, factori chemotactici pentru neutrofile şi eozinofile din mastocitele tisulare amorsează răspunsul inflamator local şi cresc permeabilitatea capilară determinând exudaţie; hipoperfuzia din focarul lezional (prin încetinirea fluxului sangvin microcirculator, edem interstiţial) determină hipoxie, acidoză, perturbarea metabolismului energetic local cu disfuncţie şi edem celular.
Modificările precoce din focarul lezional sunt însoţite de modificări sistemice declanşate de oricare dintre următorii stimuli: durere, răspuns emoţional, hipovolemie, modificări ale pH-ului sau PO2 şi PCO2 sangvin sau tisular,
modificări în disponibilul de glucoză sau de alte substanţe energetice, modificări ale temperaturii organismului, factori eliberaţi din ţesuturile traumatizate, infecţia.Durerea locală, produsă prin stimularea nociceptorilor de către prostaglandine, potasiul şi histamina eliberate local (aşa numitele
pain producing substances - PPS) şi transmisă ascendent prin tracturile spinotalamice la talamus, cortex şi sistemul limbic, constituie semnalul iniţial aferent ce avertizează despre existenţa traumatismului. Ea determină atât direct cât şi indirect (prin intermediul reacţiei emoţionale de teamă, anxietate sau mânie) amplificarea descărcării nervoase simpatice. Răspunsul imediat de durere apare înainte ca stimulul hipovolemic să fie suficient de intens pentru a activa descărcările simpatice şi medulo-suprarenale de catecolamine. Pe de altă parte, uneori, durerea şi reacţia emoţională la traumă se pot constitui într-un stimul puternic inhibitor al centrului vasomotor (cu creşterea capacitanţei vasculare şi reducerea întoarcerii venoase) adăugând la componenta hipovolemică o componentă neurogenă de agravare a şocului.SINDROMUL DE INSUFICIENŢĂ MULTIPLĂ DE SISTEME ŞI ORGANE
Sindromul de insuficienţă multiplă de sisteme şi organe (MSOF) este considerat expresia unei reacţii "inflamatorii" generalizate la o agresiune tisulară implicând acţiunea "în cascadă" a mediatorilor (TNF, interleukine) de origine macrofagică, limfocitară, responsabili de o atingere multiviscerală. [11]
Deşi sepsa este cea mai frecventă cauză a MSOF, totuşi într-un numar relativ important de cazuri, stimuli neinfecţioşi (cum sunt ischemia,
traumatismele) - culminează prin modificări stereotipice fiziopatologice cu leziuni tisulare, eliberare de mediatori şi scăderea apărării organismului.Disfuncţiile oculte ale mecanismelor imuno-reglatorii hepatice şi gastro-intestinale predispun la MSOF. Ficatul este pivotul mecanismelor de apărare a organismului prin activitatea fagocitelor mononucleare, producţia şi exportul mediatorilor endogeni ai inflamaţiei - incluzând citokinele şi eicosanoizii - clearence-ul biliar al acestor mediatori şi sinteza reactanţilor de fază acută. Şapte sunt organele şi sistemele care prin disfuncţia lor, în evoluţie, duc la MSOF:
Definiţia fiziologică a MSOF este disfuncţia severă a cel puţin 2 sisteme de organe care durează cel puţin 24 - 48 ore.
Deşi sumaţia organelor şi sistemelor nu explică adecvat modificările fundamentale în reglarea apărării organismului, prin reacţiile sale imune şi inflamatorii, din punct de vedere practic, modelul sumativ este util prognosticului MSOF.
Dereglările interacţiunii în axa intestin-ficat determină endotoxemie şi translocaţie bacteriană. Răspunsul inadecvat la sepsă conduce la pierderea controlului organismului faţă de endotoxemie şi bacteriemie. Răspunsul prompt amplificat şi/sau prelungit al citokinelor faţă de bacterii şi produşii lor prin TNF (caşectina) şi interleukine IL 1, IL 2, IL 6, poate induce leziuni tisulare, parte prin PAF şi eicosanoide.
Interacţiunile sinergice dintre răspunsurile imunologice şi mecanismele fiziologice amplifică leziunile tisulare prin complement, kinine, cascada coagulării, leziunile oxidante mediate de radicalii de O2 şi eliberarea locală de protează, elastază şi colagenază prin activarea fagocitelor.
Spre deosebire de şoc, mecanismul de producere al MSOF nu este hemodinamic ci imunologic şi determină primar leziune celulară şi secundar modificări hemodinamice precum şi leziuni în toate organele şi sistemele de organe.
Există 2 categorii de mecanisme care stau la baza fiziopatologiei MSOF:
În prezent, s-au conturat trei ipoteze privind patogenia MSOF:
Toate cele trei teorii au o cale comună, patogenică, stereotipică, prin participarea aceloraşi mediatori celulari.
Deci, oricare ar fi natura agresiunii, organismul reacţionează cu o manifestare stereotipă. Sistemul imunitar şi mediatorii endogeni participă la acest răspuns. În mod normal, aceşti factori intervin în mecanismele de apărare locală şi cicatrizare. Stimularea lor neadecvată determină generalizarea reacţiei inflamatorii la nivelul mai multor organe. Acestă reacţie, iniţial benefică, determină perturbarea anumitor funcţii celulare:
Determinările care fac obiectul lucrării de faţă au fost realizate pe un lot de 30 de bolnavi în stare de şoc traumatic internaţi în secţia de Anestezie - Terapie Intensivă a Spitalului Judeţean Constanţa, în perioada decembrie 1997 - iulie 1998.
În aprecierea gradului de şocare s-au avut în vedere următoarele criterii clinice:
|
Pierderea de sânge (ml) |
% din volumul sangvin total |
Grad de severitate |
Tablou clinic |
|
0-500 |
0-10% |
Fără şoc |
Fără manifestări |
|
500-1200 |
10-25% |
Şoc uşor |
Tahicardie, scăderea TA, sau TA compensată, vasoconstricţie periferică |
|
1200-1800 |
25-35% |
Şoc mediu |
Puls filiform, TA scăzută, transpiraţii, anxietate, agitaţie, oligurie |
|
1800-2500 |
35-50% |
Şoc sever |
Ca mai sus, dar cu puls peste 120, TA sub 60 mmHg, centralizarea circulaţiei, anurie . |
Politraumatism = lezarea simultană a mai multor regiuni corporale sau sisteme de organe, dintre care cel puţin o leziune sau asocierea mai multor leziuni pun viaţa în primejdie. Cauza cea mai frecventă o constituie accidentele de circulaţie.
Clasificare:
|
Grad |
Evaluarea leziunilor |
Semne |
Exemple |
|
I |
Gravitate mare |
Fără şoc |
TCC 1° + max. 2 fracturi ale extremităţii superioare sau fractură de gambă sau fractură ant. de inel pelvin |
|
II |
Leziuni grave, iniţial fără risc vital |
Şoc, pierdere de sânge aproximativ 25%, PaO2 scăzută |
TCC 2° + fractură de coapsă sau 2 fracturi de gambă, fracturi deschise 2°- 3°, fractură complexă de inel pelvin |
|
III |
Leziuni ameninţătoare de viaţă |
Şoc sever, pierdere de sânge până la 50%, PaO2 sub 60 mmHg |
TCC 3°, leziuni toracice şi abdominale, leziuni închise/deschise ale extremităţilor, lezarea organelor parenchimatoase (splină, ficat, plămâni) |
Clasificarea traumatismelor cranio-cerebrale (TrCC)
|
Lovitură la cap fără tulburarea sau pierderea conştienţei |
|
|
TrCC: lovitură la cap cu pierderea/tulburarea stării de conştienţă, respectiv cu vomă, cefalee intensă. Clasificare în 3 grade, după semnele clinice şi TCC: |
|
|
TCC 1° |
Comoţie cerebrală: tulburare a stării de conştienţă de scurtă durată, fără modificări morfologice pe TCC |
|
TCC 2° |
Contuzie cerebrală uşoară |
|
TCC 3° |
Contuzie cerebrală severă |
|
|
Funcţia neurologică |
Scor |
|
Deschiderea ochilor |
Spontană |
4 |
|
|
La comenzi verbale |
3 |
|
|
La stimulare dureroasă |
2 |
|
|
Lipsa reacţiei |
1 |
|
Reacţia verbală |
Orientat |
5 |
|
Confuz, dezorientat |
4 |
|
|
|
Cuvinte fără legătură |
3 |
|
|
Sunete neinteligibile |
2 |
|
|
Lipsa reacţiei verbale |
1 |
|
Reacţia motorie la stimuli dureroşi |
Răspunde solicitării |
6 |
|
|
Reacţie de apărare localizată la durere |
5 |
|
|
Mişcări în masă |
4 |
|
|
Sinergii de flexie |
3 |
|
|
Sinergii de extensie |
2 |
|
|
Lipsa reacţiei |
1 |
|
Suma dă scorul comei şi face posibilă o apreciere standardizată a gradului de severitate. Nici un răspuns la durere + nici un răspuns verbal + nu deschide ochii = 3
|
||
Iată care a fost structura lotului:
Structura pe sexe a lotului de bolnavi studiat a fost următoarea: din cei 30 de pacienţi 12 au fost de sex feminin (reprezentând un procent de 40%) iar 18 au fost de sex masculin (60 % din total).
|
Vârsta |
Martor |
Lot test |
||
|
Femei |
Bărbaţi |
Femei |
Bărbaţi |
|
|
20 - 30 ani |
2 |
2 |
2 |
2 |
|
30 - 40 ani |
2 |
5 |
2 |
1 |
|
40 - 50 ani |
1 |
6 |
3 |
4 |
|
50 - 60 ani |
2 |
3 |
2 |
6 |
|
60 - 70 ani |
4 |
3 |
3 |
5 |
|
Total parţial |
11 |
19 |
12 |
18 |
|
Total |
30 |
30 |
||
|
TCC acute deschise + fracturi costale |
7 |
|
TCC acute deschise + alte leziuni |
7 |
|
TCC acute închise + fracturi costale |
4 |
|
TCC acute închise + traumatism abdominal deschis |
1 |
|
TCC acute închise + traumatisme abdominale inchise |
4 |
|
TCC acute închise + alte leziuni |
3 |
|
Alte tipuri de leziuni (4) |
4 |
Tabel cu patologia fiecărui caz în parte
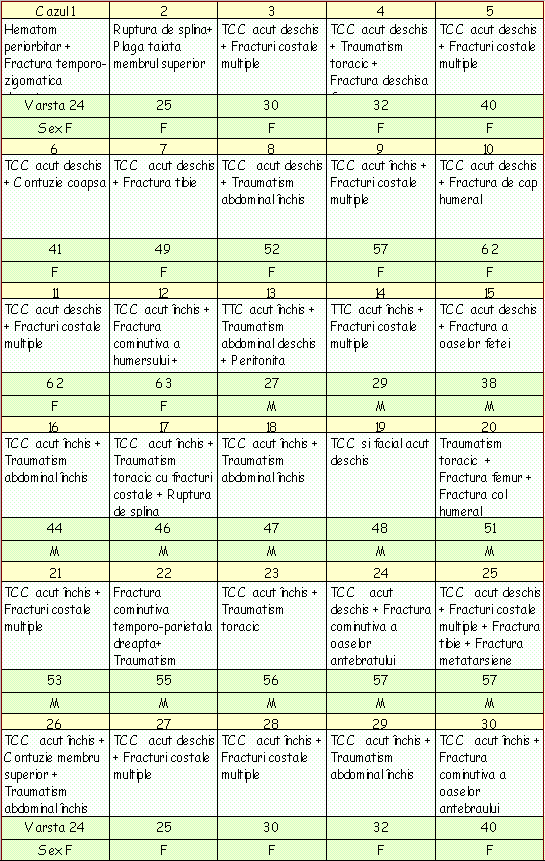
Dimensiunea lotului a fost limitată de:
Pentru constituirea unui sistem de referinţă cât mai valid şi în interpretarea rezultatelor obţinute prin investigarea lotului de bolnavi, măsurarea aceloraşi parametri s-a efectuat şi pe un lot martor de 30 subiecţi, selectaţi din populaţia generală (persoane cu o stare clinică compensată la care nu se evidenţiază clinic prezenţa unei stări de şoc) astfel încât repartiţia acestora pe sexe şi grupe de vârstă să fie cât mai asemănătoare cu cea a lotul de bolnavi luat în studiu.
Lotul de bolnavi a fost urmărit în evoluţie, fiecare pacient fiind supus la trei serii de investigaţii:
La fiecare serie de determinări, pe lângă dozarea HbO2 (obiectivul propriu-zis al lucrării) şi a altor compuşi hemoglobinici, bolnavilor li s-au efectuat şi alte explorări (frecvenţa cardiacă, tensiunea arterială, etc); aceste determinări au fost prezentate din considerentul de a plasa rezultatele obţinute în contextul clinic şi paraclinic în care au fost efectuate dozările.
Lotul martor a fost investigat după aceeaşi metodă.
Determinarea derivaţilor hemoglobinei s-a realizat printr-o metodă invazivă - oximetria; astfel, s-au prelevat probe de sânge prin puncţie arterială şi venoasă, prelucrate ulterior cu ajutorul unui analizor de tip AVL 912 OXYLITE.
Deşi nivelul de oxihemoglobină sangvină ar putea fi determinat printr-o metodă neinvazivă (pulsoximetria), care ar fi prezentat avantajele ce derivă din caracterul său neinvaziv (uşurinţa executării, înlăturarea riscului apariţiei incidentelor şi accidentelor specifice unei tehnici invazive, posibilitatea monitorizăii permanente), a fost preferată metoda invazivă datorită:
Principalul dezavantaj al metodei folosite derivă din caracterul său invaziv - căci expune la o serie de riscuri, metoda este laborioasă, costisitoare şi limitează posibilitatea de repetare rapidă a determinărilor.
Prelevarea sângelui arterial s-a realizat prin puncţionarea arterei radiale, la nivelul şanţului radial.
Artera radială este ramul de continuare directă al arterei brahiale. A. radială începe de la 1 cm sub plica cotului, prezentând în traiectul său trei porţiuni, respectiv: la antebraţ, de-a lungul marginii radiale a acestuia, a doua la încheietura mâinii şi a treia la nivelul mâinii. Linia de proiecţie a arterei la nivelul antebraţului este dată de unirea unui punct proximal, situat la marginea medială a tendonului radial al bicepsului, cu un punct distal situal la extremitatea şantului pulsului (şantul radial), deasupra apofizei stiloide a radiusului. Artera poate fi palpată în cele 2/3 inferioare, fiind situată superficial. În 1/3 inferioară, în şanţul pulsului, ea se găseşte imediat sub tegument şi fascia superficială, între tendoanele muşchilor palmar mare (medial) şi lung supinator (lateral), pe faţa anterioară a muşchiului pătrat pronator.
Materiale necesare:
Tehnica prelevării sângelui arterial:
De menţionat că în timpul recoltării probelor prin această tehnică, nu s-au produs hematoame la nivelul puncţiei.
Recoltarea sângelui venos s-a realizat prin puncţia venelor superficiale de la nivelul plicii cotului sau de la nivelul regiunii dorsale a mâinii.
Reţeaua venoasă superficială a plicii cotului este situată imediat sub tegument, deasupra fasciei superficiale. Ea este formată din venele: radială superficială, cubitală superficială, mediană a cotului, medio-cefalică, medio-bazilică. Reţeaua superficială comunică cu venele profunde ale regiunii prin vena comunicantă, drenând sângele venos de la nivelul mâinii şi antebraţului în venele cefalică şi bazilică.
De multe ori s-a recoltat sânge venos de la nivelul regiunii dorsale a mâinii (venele metacarpiene dorsale şi vena cefalică a policelui) încercându-se astfel ca zona plicii cotului să fie menajată sau datorită faptului că la nivelul plicii cotului existau deja perfuzii.
Materiale necesare:
Tehnica recoltării:
În toate cazurile a fost posibilă evidenţierea şi puncţionarea venei şi nu s-au înregistrat incidente de tipul introducerii de aer în venă sau puncţionarii unei artere în locul venei.
Prin acestă tehnică de recoltare, transport (imediat) şi prelucrare se evită la maximum contactul probei (în special al hemoglobinei reduse, avidă de oxigen) cu aerul atmosferic, ca şi variaţiile de temperatură (fapte care ar altera precizia rezultatelor determinărilor (prin influenţarea curbei de disociaţie a Hb).
Determinarea concentraţiei hemoglobinei şi a compuşilor săi s-a realizat cu ajutorul unui aparat de tip AVL 912 OXILITE (fabricat în 1992), a cărui funcţionare se bazează pe utilizarea metodei fotometrice.
Când lumina trece printr-o soluţie colorată, o parte este absorbită, cealaltă transmisă, gri sau neagră, în funcţie de capacitatea sa de absorbţie. Dacă este absorbită doar o parte din lumină şi anume, cea care face parte dintr-un anume domeniu spectral, substanţa respectivă va apărea colorată în culorile complementare domeniului spectral absorbit.
Sângele absoarbe în special în culoarea verde, ca urmare apărând colorat în roşu. Aparatul măsoară deci concentraţia diferiţilor compuşi ai hemoglobinei prin metoda fotometrică, bazată tocmai pe existenţa spectrelor de absorbţie specifice fiecărui compus fiziologic sau patologic al hemoglobinei. Astfel:
Absorbţia luminii este determinată prin măsurarea intensităţii luminii incidente (I) şi a celei transmise (I0).
Raportul dintre cele două valori determinate reprezintă gradul de transmisie, care cuantifică absorbţia luminii:
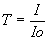
unde T este gradul de transmisie a luminii.
Conform formulei Lambert-Beer, absorbţia este definită ca logaritm al inversului gradului de transmisie şi este direct proporţională cu concentraţia substanţei respective şi cu distanţa parcursă de lumină prin probă:
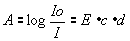
unde
A este absorbţia, E este coeficientul molar de absorbţie, c este concentraţia substanţei în proba pe care o analizăm şi d este grosimea probei.Dintre termenii relaţiei de mai sus, se cunosc:
Aparatul măsoară:
Se obţine astfel concentraţia (c) a compusului urmărit, conform formulei:
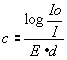
Introducerea probei de sânge în sistemul de intrare al aparatului se realizează fie introducând capilarul cu proba de analizat în dispozitivul special al aparatului, fie se procedează astfel:
Sângele, odată introdus în sistemul de intrare, este transportat la hemolizor prin intermediul unei pompe peristaltice. În hemolizor eritrocitele sunt distruse cu ajutorul ultrasunetelor. Bulele de gaz care apar în urma acestui proces sunt îndepărtate cu ajutorul unui tub de sticlă numit "capcana pentru bule". În concordanţă cu structura lor chimică compuşii hemoglobinei prezintă spectre de absorbţie specifice, aşa după cum s-a arătat mai înainte. Selectarea lungimilor de undă (
l ) necesare pentru identificarea fiecărui derivat hemoglobinic se face cu ajutorul unui monocromator dirijat automat de un motor.În cuva de măsură, proba este traversată în mod secvenţial de pulsuri de lumină de culori diferite (cu lungimi de undă diferite). Pentru măsurarea concentraţiei celor cinci derivaţi hemoglobinici determinaţi de aparat ar fi suficiente cinci pulsuri luminoase (fiecare având
l specifică compusului pe care îl identifică şi măsoară).Totuşi, în probă mai pot rămâne fragmente de membrană eritrocitară care ar influenţa rezultatele măsurătorilor. În scopul înlăturării acestor posibile influenţe, analizorul lucrează cu mai mult de cinci lungimi de undă diferite. După emiterea pulsului de lumină, o fotodiodă determină intensitatea luminii transmise prin stratul de probă pentru fiecare puls în parte. Durata întregului proces este de numai câteva fracţiuni de secundă. Proba este ulterior evacuată iar sistemul de măsurare este spălat cu ajutorul unei pompe de vid.
Procesul de măsurare se reia apoi, înlocuind proba cu apa de clătire şi folosind acelaşi tip de pulsuri luminoase. Din această a doua măsurare se obţine valoarea de referinţă, respectiv intensitatea luminii incidente (I0). Astfel erorile care ar putea fi cauzate de reflectarea luminii pe suprafaţa cuvei ce conţine proba sau absorbţia luminii de către materialul din care este confecţionată cuva, pot fi determinate şi luate în calcul, pentru acurateţea rezultatelor măsurătorii.
Folosind raportul dintre măsurătorile pentru sânge şi cele pentru apă, analizorul calculează absorbţia (A) şi de aici - concentraţia derivaţilor hemoglobinici.
Analizorul AVL 912 determină următorii compuşi ai hemoglobinei:
a) Compuşi fiziologici ai hemoglobinei:
b) Compuşi patologici ai hemoglobinei:
Conversii:
Hb (g/dL) = Hb (mmol/L)
T 1,6125O2CT (vol %) = HbO2 (mmol/L)
T H T 1,6125(H este factorul de legare al O2 (puterea de oxigenare) = 1,39.
În urma determinărilor efectuate pe lotul de bolnavi descris, în condiţiile şi prin metoda prezentată, s-au obţinut rezultate ce le-am înscris sub forma unui tabel în aşa fel încât citirea evoluţiei fiecărui caz în parte să se facă cu uşurinţă. Astfel, parametrii determinaţi (HbO2, RHb, temperatură, leucocite, tensiune arterială, etc) pot fi urmăriţi în dinamica lor - observându-se, în acelaşi tabel şi etiologia şocului traumatic al cazului respectiv. Parametrii urmăriţi au fost:
Patologia traumatică, Vârsta (V), Evoluţia cazului (Ev), Sex (S), Alura ventriculară (AV), Temperatura cutanată (°C) (t°), Tensiunea arterială maximă (TAmax) (mmHg), Tensiunea arterială minimă (TAmin) (mmHg), Tensiunea arterială medie (TAmed) (mmHg), Respiraţii/minut (R), Scor Glasgow (SCG), Indicele de şoc Allgower (ISA), Leucocite (/mm3) (L), Hemoglobina totală (†Hb) (g/dL), Oxihemoglobina din sângele arterial (Hb02 a) (g/dL), Oxihemoglobina din sângele venos (Hb02 v) (g/dL), Diferenţa Hb02 a - Hb02 v (g/dL), Deoxihemoglobina din sângele arterial (RHb a) (g/dL), Deoxihemoglobina în sângele venos (RHb v) (g/dL), Saturaţia în oxigen a sângelui arterial (O2Sat a) (%), Saturaţia în oxigen a sângelui venos (O2Sat v) (%), Diferenţa O2Sat a - O2Sat v (%).
Indicii 1, 2, respectiv 3 desemnează prima. a doua, respectiv a treia determinare.
Pentru fiecare parametru în parte a fost calculată MEDIA, MINIMA, MAXIMA, MEDIANA şi DEVIAŢIA STANDARD (SD) şi VARIANŢA.
Prelucrarea statistică a datelor a fost realizată folosind Student test - analiza pentru două şiruri considerate neasemănătoare pentru a determina dacă există sau nu diferenţe semnificative între valorile obţinute pe lotul test comparativ cu cel martor; s-a efectuat de asemenea o confruntare între seriile valorilor obţinute la pacienţii cu evoluţie favorabilă comparativ cu pacienţii care au avut o evoluţie nefavorabilă. În testul efectuat valoarea indicelui
a este de 0,002 (pentru a ne da rezultatul testul raportat la o probabilitate de 99.8%).Atât pe lotul de bolnavi cât şi pe lotul martor s-au determinat şi nivelurile de Met-Hb, Co-Hb şi S-Hb, acestea dovedindu-se de valori mici, în limitele admise drept fiziologice (sub 1% din cantitatea totală de hemoglobină).
Tabel cu parametrii analizaţi pentru lotul martor:
|
Parametrul analizat |
Martor 1 |
M2 |
M3 |
M4 |
M5 |
M6 |
M7 |
|
Vârsta (V) |
28 |
29 |
37 |
39 |
43 |
51 |
51 |
|
Sex (S) |
F |
F |
F |
F |
F |
F |
F |
|
Alura ventriculară (AV) |
68 |
72 |
70 |
80 |
72 |
72 |
74 |
|
Temperatura cutanată (°C) |
37 |
37 |
36.8 |
36.8 |
37.2 |
36.5 |
36.5 |
|
Tensiunea arteriala maximă (TAmax) (mmHg) |
120 |
125 |
135 |
130 |
120 |
150 |
130 |
|
Tensiunea arterială minimă (TAmin) (mmHg) |
60 |
60 |
80 |
80 |
65 |
90 |
65 |
|
Tensiunea arterială medie (TAmed) (mmHg) |
80 |
82 |
98 |
97 |
83 |
110 |
87 |
|
Respiraţii/minut (R) |
18 |
16 |
16 |
18 |
20 |
20 |
16 |
|
Leucocite(/mm3) (L) |
8000 |
7400 |
7000 |
5800 |
9200 |
6500 |
10600 |
|
Hemoglobina totală (†Hb) (g/dL) |
13.8 |
13.9 |
14.0 |
14.1 |
13.5 |
12.6 |
13.7 |
|
Oxihemoglobina în sângele arterial (O2Hb a) (g/dL) |
13.4 |
13.4 |
13.7 |
13.6 |
13.2 |
12.0 |
13.1 |
|
Oxihemoglobina în sângele venos (O2Hb v) (g/dL) |
9.3 |
10.1 |
9.8 |
10.2 |
9.9 |
9.4 |
9.5 |
|
Diferenţa arterio-venoasă (O2Hb a - v) (g/dL) |
4.1 |
3.3 |
3.9 |
3.5 |
3.2 |
2.7 |
3.6 |
|
Deoxihemoglobina în sângele arterial (RHb a) (g/dL) |
0.2 |
0.4 |
0.2 |
0.4 |
0.1 |
0.5 |
0.5 |
|
Deoxihemoglobina în sângele venos (RHb v) (g/dL) |
4.3 |
3.7 |
4.1 |
3.9 |
3.4 |
3.1 |
4.1 |
|
Saturaţia în oxigen a sângelui arterial (O2Sat a) (%) |
98.8 |
96.9 |
98.4 |
97.4 |
98.9 |
96.2 |
96.1 |
|
Saturaţia în oxigen a sângelui venos (O2Sat v) (%) |
68.4 |
73.2 |
70.5 |
72.5 |
74.5 |
74.9 |
69.6 |
|
Diferenţa arterio-venoasă pentru saturaţia în oxigen (O2Sat a - v) (g/dL) |
30.4 |
23.7 |
27.9 |
24.9 |
24.4 |
21.3 |
26.5 |
Tabel cu parametrii analizaţi pentru lotul martor (continuare):
|
PARAMETRUL ANALIZAT |
M8 |
M9 |
M10 |
M11 |
M12 |
M13 |
M14 |
|
Vârsta (V) |
62 |
63 |
65 |
68 |
25 |
27 |
31 |
|
Sex (S) |
F |
F |
F |
F |
M |
M |
M |
|
Alura ventriculară (AV) |
70 |
74 |
70 |
68 |
76 |
72 |
74 |
|
Temperatura cutanată (°C) |
36.4 |
36.8 |
37 |
36.5 |
36.5 |
36.4 |
36.7 |
|
Tensiunea arteriala maximă (TAmax) (mmHg) |
150 |
150 |
155 |
165 |
120 |
110 |
120 |
|
Tensiunea arterială minimă (TAmin) (mmHg) |
80 |
80 |
90 |
90 |
70 |
60 |
60 |
|
Tensiunea arterială medie (TAmed) (mmHg) |
103 |
103 |
112 |
115 |
87 |
77 |
80 |
|
Respiraţii/minut (R) |
18 |
16 |
16 |
18 |
14 |
14 |
16 |
|
Leucocite (/mm3) (L) |
7300 |
9300 |
9800 |
5400 |
6000 |
6300 |
7800 |
|
Hemoglobina totală (†Hb) (g/dL) |
14.4 |
13.2 |
11.9 |
12.8 |
16.8 |
14.4 |
15.2 |
|
Oxihemoglobina în sângele arterial (O2Hb a) (g/dL) |
13.8 |
12.3 |
11.0 |
12.0 |
16.6 |
14.0 |
14.8 |
|
Oxihemoglobina în sângele venos (O2Hb v) (g/dL) |
10.3 |
9.1 |
8.3 |
8.8 |
11.8 |
10.2 |
10.5 |
|
Diferenţa arterio-venoasă (O2Hb a - v) (g/dL) |
3.4 |
3.1 |
2.7 |
3.2 |
4.7 |
3.8 |
4.3 |
|
Deoxihemoglobina în sângele arterial (RHb a) (g/dL) |
0.5 |
0.7 |
0.7 |
0.7 |
0.2 |
0.4 |
0.3 |
|
Deoxihemoglobina în sângele venos (RHb v) (g/dL) |
4.0 |
3.9 |
3.4 |
3.9 |
5.0 |
4.2 |
4.6 |
|
Saturaţia în oxigen a sângelui arterial (O2Sat a) (%) |
96.4 |
94.3 |
93.9 |
94.6 |
98.6 |
97.3 |
98.3 |
|
Saturaţia în oxigen a sângelui venos (O2Sat v) (%) |
72.3 |
70.1 |
70.6 |
69.2 |
70.4 |
71.0 |
69.8 |
|
Diferenţa arterio-venoasă pentru saturaţia în oxigen (O2Sat a - v) (g/dL) |
24.1 |
24.2 |
23.3 |
25.4 |
28.2 |
26.3 |
28.5 |
Tabel cu parametrii analizaţi pentru lotul martor (continuare):
|
Parametrul analizat |
M15 |
M16 |
M17 |
M18 |
M19 |
M20 |
M21 |
|
Vârsta (V) |
31 |
32 |
36 |
37 |
40 |
40 |
45 |
|
Sex (S) |
M |
M |
M |
M |
M |
M |
M |
|
Alura ventriculară (AV) |
82 |
72 |
82 |
72 |
76 |
76 |
80 |
|
Temperatura cutanată (°C) |
36.5 |
37 |
36.5 |
37 |
36.8 |
36.2 |
36.8 |
|
Tensiunea arteriala maximă (TAmax) (mmHg) |
120 |
130 |
120 |
130 |
125 |
130 |
130 |
|
Tensiunea arterială minimă (TAmin) (mmHg) |
65 |
65 |
65 |
65 |
60 |
70 |
65 |
|
Tensiunea arterială medie (TAmed) (mmHg) |
83 |
87 |
83 |
87 |
82 |
90 |
87 |
|
Respiraţii/minut (R) |
16 |
18 |
16 |
18 |
18 |
16 |
14 |
|
Leucocite (/mm3) (L) |
5900 |
9000 |
5900 |
9000 |
8400 |
6800 |
7500 |
|
Hemoglobina totală (†Hb) (g/dL) |
16.3 |
16.4 |
16.3 |
16.4 |
16.7 |
16.5 |
15.8 |
|
Oxihemoglobina în sângele arterial (O2Hb a) (g/dL) |
15.9 |
15.8 |
15.9 |
16.2 |
16.3 |
15.7 |
15.6 |
|
Oxihemoglobina în sângele venos (O2Hb v) (g/dL) |
11.8 |
11.7 |
12.1 |
11.9 |
12.3 |
11.7 |
11.1 |
|
Diferenţa arterio-venoasă (O2Hb a - v) (g/dL) |
4.1 |
4.1 |
3.8 |
4.2 |
4.0 |
4.0 |
4.5 |
|
Deoxihemoglobina în sângele arterial (RHb a) (g/dL) |
0.2 |
0.5 |
0.2 |
0.1 |
0.2 |
0.5 |
0.1 |
|
Deoxihemoglobina în sângele venos (RHb v) (g/dL) |
4.3 |
4.6 |
4.0 |
4.4 |
4.2 |
4.5 |
4.6 |
|
Saturaţia în oxigen a sângelui arterial (O2Sat a) (%) |
98.9 |
96.8 |
98.7 |
99.1 |
98.8 |
97.0 |
99.3 |
|
Saturaţia în oxigen a sângelui venos (O2Sat v) (%) |
73.2 |
71.8 |
75.1 |
73.1 |
74.7 |
72.3 |
70.5 |
|
Diferenţa arterio-venoasă pentru saturaţia în oxigen (O2Sat a - v) (g/dL) |
25.7 |
25.0 |
23.6 |
26.0 |
24.1 |
24.7 |
28.8 |
Tabel cu parametrii analizaţi pentru lotul martor (continuare):
|
Parametrul analizat |
M22 |
M23 |
M24 |
M25 |
M26 |
M27 |
M28 |
|
Vârsta (V) |
46 |
48 |
49 |
53 |
55 |
57 |
63 |
|
Sex (S) |
M |
M |
M |
M |
M |
M |
M |
|
Alura ventriculară (AV) |
68 |
74 |
76 |
64 |
68 |
68 |
70 |
|
Temperatura cutanată (°C) |
36.5 |
36.6 |
36.5 |
36.8 |
36.5 |
37.2 |
36.9 |
|
Tensiunea arteriala maximă (TAmax) (mmHg) |
135 |
140 |
140 |
140 |
135 |
160 |
165 |
|
Tensiunea arterială minimă (TAmin) (mmHg) |
80 |
80 |
75 |
70 |
70 |
90 |
90 |
|
Tensiunea arterială medie (TAmed) (mmHg) |
98 |
100 |
97 |
93 |
92 |
113 |
115 |
|
Respiraţii/minut (R) |
16 |
16 |
16 |
16 |
18 |
18 |
18 |
|
Leucocite (/mm3) (L) |
7400 |
9400 |
6600 |
7500 |
9500 |
8800 |
5900 |
|
Hemoglobina totală (†Hb) (g/dL) |
17.0 |
15.3 |
14.9 |
17.4 |
14.8 |
17.6 |
13.5 |
|
Oxihemoglobina în sângele arterial (O2Hb a) (g/dL) |
16.6 |
14.6 |
14.2 |
16.8 |
13.8 |
16.2 |
12.4 |
|
Oxihemoglobina în sângele venos (O2Hb v) (g/dL) |
12.9 |
10.6 |
10.5 |
11.9 |
10.2 |
11.9 |
9.6 |
|
Diferenţa arterio-venoasă (O2Hb a - v) (g/dL) |
3.7 |
4.0 |
3.8 |
4.9 |
3.6 |
4.3 |
2.7 |
|
Deoxihemoglobina în sângele arterial (RHb a) (g/dL) |
0.3 |
0.5 |
0.5 |
0.4 |
0.8 |
1.2 |
1.0 |
|
Deoxihemoglobina în sângele venos (RHb v) (g/dL) |
4.0 |
4.5 |
4.2 |
5.3 |
4.4 |
5.5 |
3.8 |
|
Saturaţia în oxigen a sângelui arterial (O2Sat a) (%) |
98.3 |
96.7 |
96.8 |
97.4 |
94.5 |
93.3 |
92.5 |
|
Saturaţia în oxigen a sângelui venos (O2Sat v) (%) |
76.4 |
70.4 |
71.2 |
69.2 |
69.9 |
68.4 |
72.0 |
|
Diferenţa arterio-venoasă pentru saturaţia în oxigen (O2Sat a - v) (g/dL) |
21.9 |
26.3 |
25.6 |
28.2 |
24.6 |
24.9 |
20.5 |
Tabel cu parametrii analizaţi pentru lotul martor (continuare):
|
Parametrul analizat |
M29 |
M30 |
Medie |
Minim |
Maxim |
Mediana |
SD |
|
Vârsta (V) |
68 |
69 |
39.7 |
28 |
51 |
39 |
9.36 |
|
Sex (S) |
M |
M |
|||||
|
Alura ventriculară (AV) |
70 |
66 |
72.6 |
68 |
80 |
72 |
3.78 |
|
Temperatura cutanată (°C) |
36.8 |
36.4 |
36.8 |
36.5 |
37.2 |
36.8 |
0.26 |
|
Tensiunea arteriala maximă (TAmax) (mmHg) |
180 |
175 |
130.0 |
120 |
150 |
130 |
10.41 |
|
Tensiunea arterială minimă (TAmin) (mmHg) |
90 |
100 |
71.4 |
60 |
90 |
65 |
11.80 |
|
Tensiunea arterială medie (TAmed) (mmHg) |
120 |
125 |
91.0 |
80 |
110 |
87 |
11.05 |
|
Respiraţii/minut (R) |
14 |
16 |
17.7 |
16 |
20 |
18 |
1.80 |
|
Leucocite (/mm3) (L) |
7200 |
7700 |
7785.7 |
5800 |
10600 |
7400 |
1649 |
|
Hemoglobina totală (†Hb) (g/dL) |
15.1 |
16.7 |
13.7 |
12.6 |
14.1 |
13.8 |
0.51 |
|
Oxihemoglobina în sângele arterial (O2Hb a) (g/dL) |
13.9 |
15.8 |
13.2 |
12.0 |
13.7 |
13.4 |
0.56 |
|
Oxihemoglobina în sângele venos (O2Hb v) (g/dL) |
10.1 |
10.8 |
9.7 |
9.3 |
10.2 |
9.8 |
0.35 |
|
Diferenţa arterio-venoasă (O2Hb a - v) (g/dL) |
3.8 |
5.0 |
3.5 |
2.7 |
4.1 |
3.5 |
0.48 |
|
Deoxihemoglobina în sângele Arterial (RHb a) (g/dL) |
1.1 |
0.8 |
0.3 |
0.1 |
0.5 |
0.4 |
0.16 |
|
Deoxihemoglobina în sângele venos (RHb v) (g/dL) |
4.9 |
5.8 |
3.8 |
3.1 |
4.3 |
3.9 |
0.42 |
|
Saturaţia în oxigen a sângelui arterial (O2Sat a) (%) |
92.7 |
95.3 |
97.5 |
96.1 |
98.9 |
97.4 |
1.19 |
|
Saturaţia în oxigen a sângelui venos (O2Sat v) (%) |
67.1 |
64.9 |
71.9 |
68.4 |
74.9 |
72.5 |
2.49 |
|
Diferenţa arterio-venoasă pentru Saturaţia în oxigen (O2Sat a - v) (g/dL) |
25.6 |
30.4 |
25.6 |
21.3 |
30.4 |
24.9 |
2.98 |
Tabel cu parametrii analizaţi pentru lotul test:
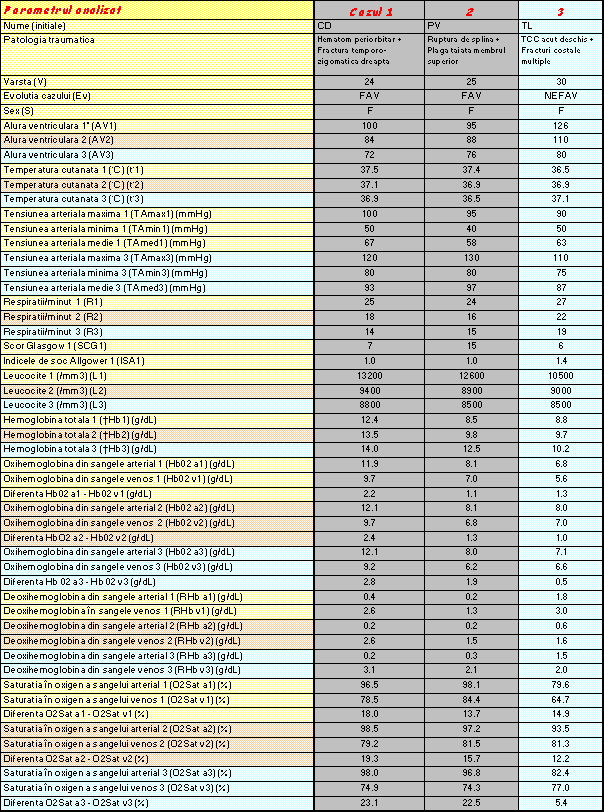
Tabel cu parametrii analizaţi pentru lotul test (continuare):
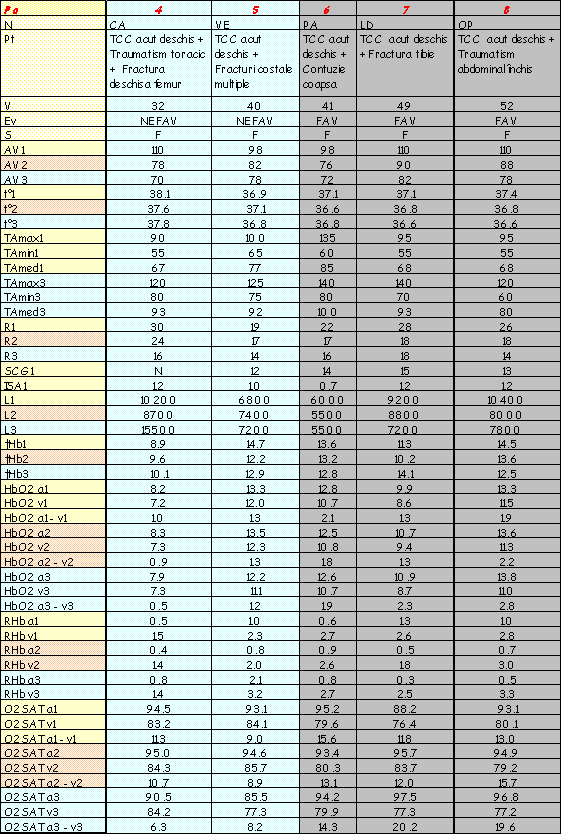
Tabel cu parametrii analizaţi pentru lotul test (continuare):
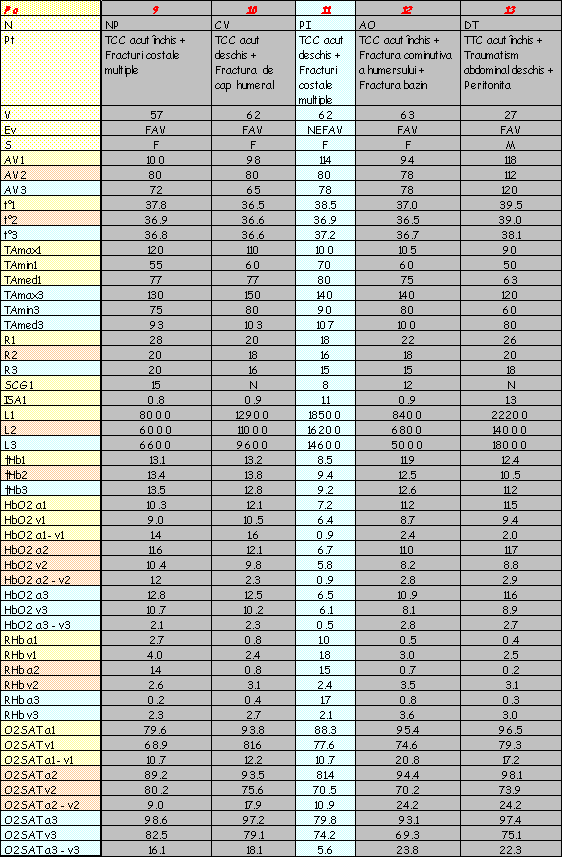
Tabel cu parametrii analizaţi pentru lotul test (continuare):
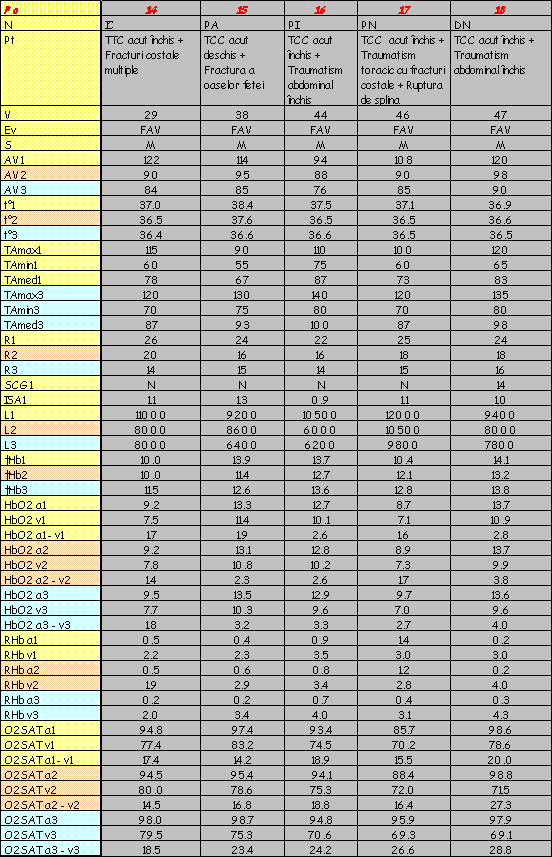
Tabel cu parametrii analizaţi pentru lotul test (continuare):
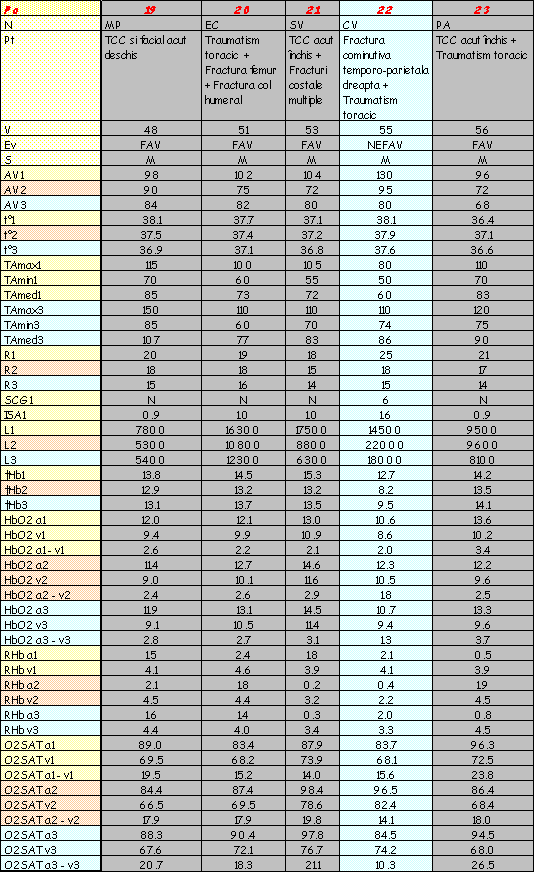
Tabel cu parametrii analizaţi pentru lotul test (continuare):
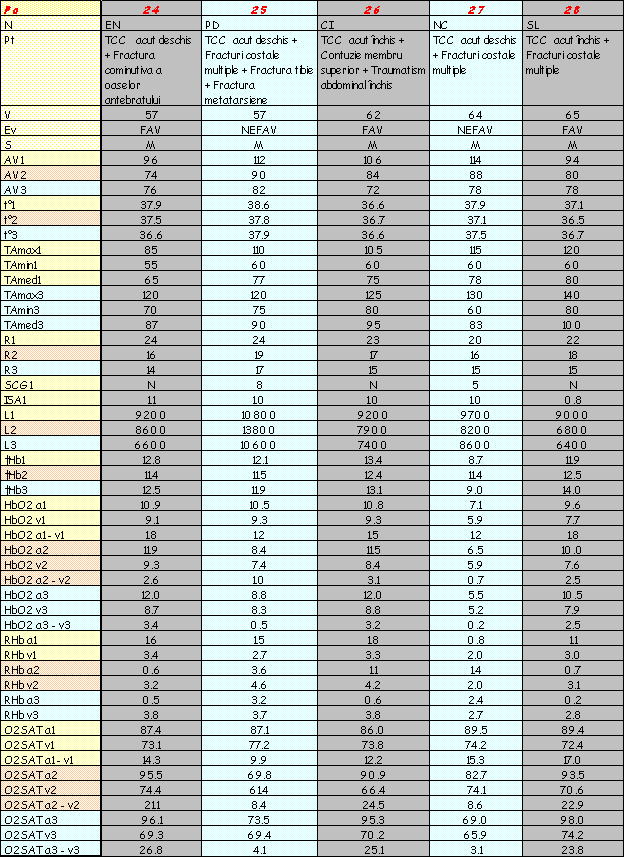
Tabel cu parametrii analizaţi pentru lotul test (continuare):
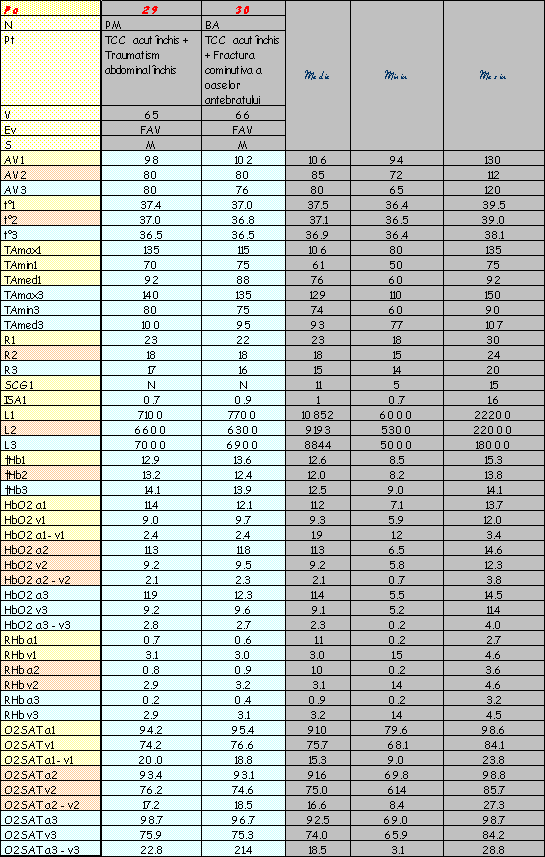
Tabel cu parametrii analizaţi pentru lotul test (continuare):
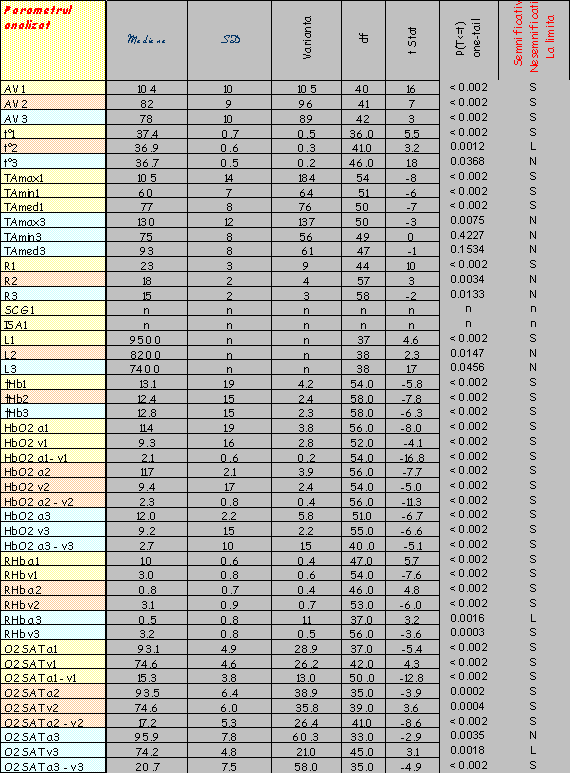
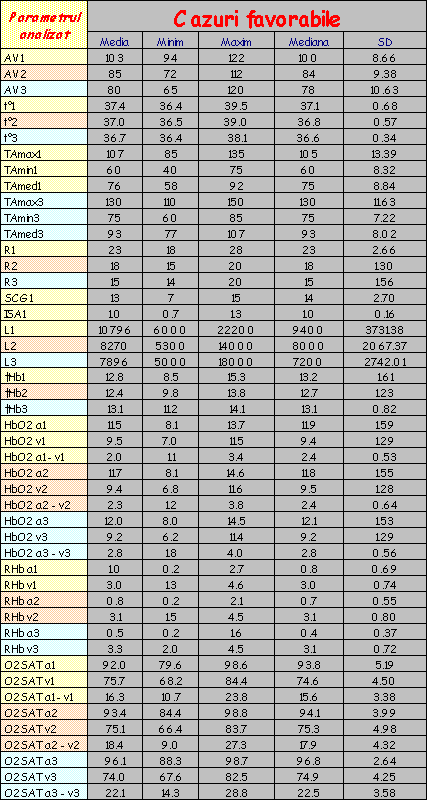
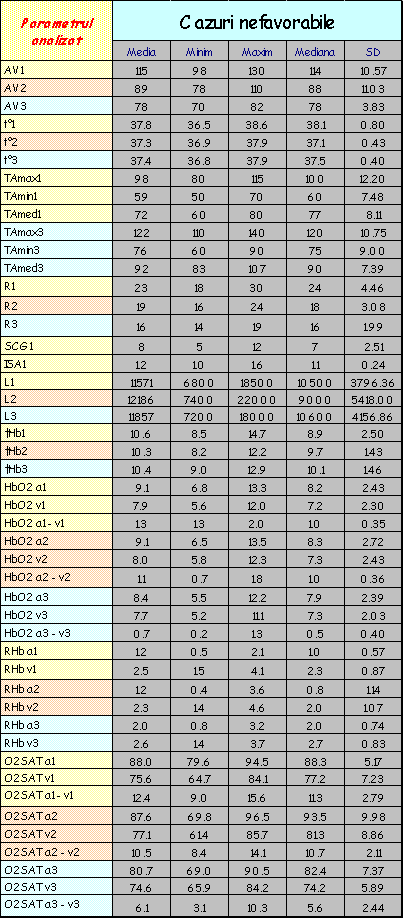
Prin studiul rezultatelor obţinute se observă că:
În cazurile cu evoluţie favorabilă, valorile primei determinări a O2Sat a arată valori cuprinse între 98.6% şi 79.6% cu o medie de 92,0%, ceea ce se dovedeşte statistic nesemnificativ faţă de lotul cazurilor cu evoluţie nefavorabilă, care a avut valori cuprinse între 79.6% şi 94,5% cu o medie de 88%.
Iată determinările saturaţiei în O2 comparativ între cele trei determinări ale lotului test, lotului martor, precum şi loturilor cazurilor favorabile şi cazurilor nefavorabile:
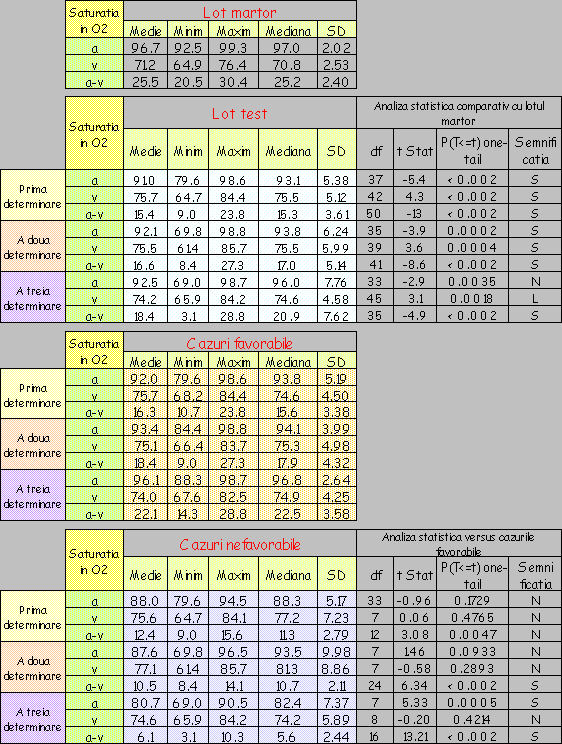
unde a = saturaţia în O2 a sângelui arterial;
v = saturaţia în O2 a sângelui venos;
a – v = diferenţa dintre saturaţia în O2 a sângelui arterial şi cea a sângeelui venos;
df, t Stat, P(T<=t) one-tail = semnificaţia statistică (test t-Student) utilizând Microsoft Excel 97, Tools - Data Analysis - t-Test: Two Sample Assuming Unequal Variences
Prin studiul rezultatelor obţinute se observă că:
În cazurile cu evoluţie bună, valorile O2Sat v arată valori cuprinse între 68,2% şi 84.4%, cu o medie de 75,7%, ceea ce se dovedeşte statistic nesemnificativ faţă de lotul cazurilor cu evoluţie nefavorabilă, care a avut valori cuprinse între 84,1%% şi 64,7% cu o medie de 75,6%.
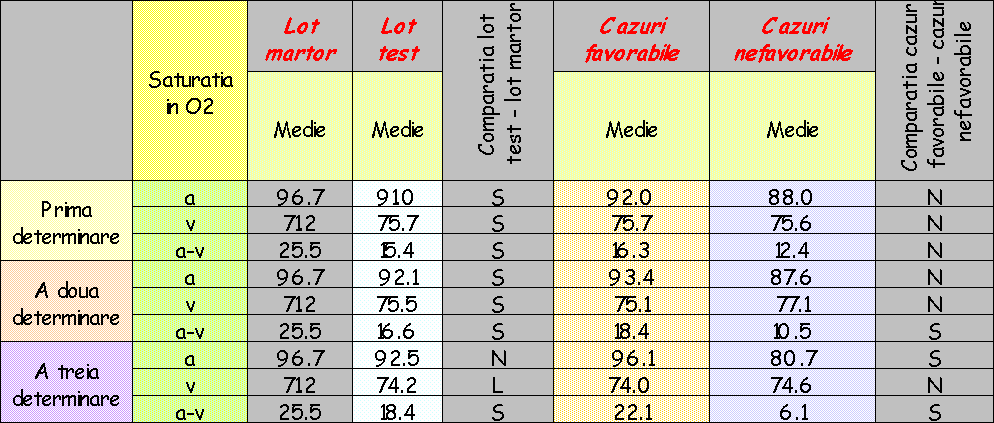
Iată saturaţia în O2 a hemoglobiei, comparativ – în valori medii la cele trei determinări pe lotul test şi determinarea pe lotul martor. Valoarea lotul martor a fost înscrisă de trei ori pentru ca diferenţele între loturile studiate să apară mai clar.
Prin studiul rezultatelor obţinute se observă că:
În cazurile cu evoluţie favorabilă, valorile primei determinări a O2Sat a–v au arătat valori cuprinse între 10,7% şi 23,6% cu o medie de 16,3%, valori ce nu diferă statistic foarte mult de cele ale lotulul cu cazuri nevaforabile.
Rezultatele obţinute în urma studiului efectuat au evidenţiat:
Toate acestea recomandă utilizarea determinării nivelului de oxihemoglobină din sângele arterial şi venos (alături de ceilalţi parametri utilizaţi în prezent: frecvenţa respiratorie, tensiunea arterială, debit cardiac, PCP, PVC, diureză, clearence renal, probe hepatice) pentru diagnosticarea şi monitorizarea ŞT, dată fiind valoarea demonstrată a dinamicii oxihemoglobinei de indicator al eficacităţii terapeutice.
|
Acalovski I - Stările de şoc. În: Sinteze clinice şi terapeutice. Urgenţele medico-chirurgicale. Lito UMF Cluj-Napoca, 1992, pp.113-117 |
|
|
2. |
Angelescu Nicolae, Patologie chirurgicală pentru admitere în rezidenţiat vol.2, Editura Celsiu, Bucureşti, 1997, pp. 2 -7 |
|
3. |
Baciu I., Fiziologie, Editura didactică şi pedagogică, 1977, pp.281-285 |
|
4. |
Badiu Gheorghe, Teodoresc-Exarcu I., et alt., Fiziologia şi fiziopatologia hemodinamicii, vol.II Sistemul circulator, Ed. Medicală, Bucureşti, pp.70-79,842-849,1359-1495 |
|
5. |
Badiu Gheorghe, Teodorescu-Exarcu I., Fiziologie, Ed. Medicală, Bucureşti, 1993, pp.25-32, 61-105, 148-151 |
|
6. |
Bernnet Claude J., Fred Plum, Cecil Textbook of Medicine, 20th ed., W.B. Saunders, 1996, pp.460-468 |
|
7. |
Braun Jörg, Ghid Clinic de Medicină Internă, Editura Medicală S.A., Bucureşti – 1997 |
|
8. |
Bullock John, Boyle Joseph III, Wang B. Michael, Physiology, 3rd ed., The National Medical Series for Independent Study, Williams & Wilkins, 1994, Baltimore, Maryland, pp. 189, 229-234 |
|
9. |
Cândrea Vasile, Bucur I., Alexandru I., Sistemul limfatic în şoc, Editura militară, Bucureşti, 1981, pp.43-65 |
|
10. |
Capan L., Miller S., Turndorf H., Trauma: Anesthesia and Intensive Care, Lippincot Comp Philadelphia 1991, pp.115-116, |
|
11. |
Cardan E., Cristea I., Chioreanu M. - Medicină Intensivă - vol.1, ed. Dacia, Cluj-Napoca, 1997, pp. 236 – 238 |
|
12. |
Chien S., Role of sympathetic nervous system in haemorrahage, Physiology Rev. 1967, pp.47:214-219 |
|
13. |
Cristea I., M.Ciobanu, Noul Ghid de ATI, Editura Medicală, Bucureşti, 1992, pp.284-285 |
|
14. |
Dobb G. - Intensive Care Manual, TE, Ohio, Butterworts, 1990, pp.375-381 |
|
15. |
Fink MP - Schock: an overview. In: Care Medicine (JM Rippe, RS Irwin, JS Alpert, MP Fink eds). Little, Brown, Boston, 1991, pp.1417-1435 |
|
16. |
Gardnier & Delamare, Dictionnaire des Termes de Médicine, 22ème Ed, Editions Maloine, 1989 |
|
17. |
Guyton C. Arthur, ediţia a 5-a, Fiziologie, Editura medicală Almatea, pp. 149 - 159, 268-276 |
|
18. |
Jack Tinker & Warren M. Zarol, Care of The Critically Ill Patient, 2nd Editon, 1992, Springer-Verlag, pp.78-86 |
|
19. |
Kumar Vinay, Cotran Cotran, Robbins Stanley L., Basic Pathology, 6th Edition W.B.Saunders 1997, pp.78-80 |
|
20. |
Mogoşeanu Aurel, Anestezie şi terapie intensivă, Editura Mirton, Timişoara, 1997, pp.177-189, 200-225 |
|
21. |
Mollison P.L. - Blood transfusion în clinical medicine, Blackwell, Oxford, 1983, pp. 57-62 |
|
22. |
Nelson L.D., Continous venous oxymetry in surgical patients, Surgery Annuary, 1987, pp.182-185 |
|
23. |
Rippe M.J., Irwin S.R., Alpert S.J., Intensive Care Medicine, 1995, pp. 278-292 |
|
24. |
Shaffer M.A. Franaszek JB - Shock. In: Emergency Medicine (Kravis TC, Werner CG, Jacobs LM eds) Raven Press, N.Y., 1993, pp.65-91 |
|
25.. |
Shomaker W., Textbook of Critical Care, 1994, I:218-221, II:491-506, III:979-992 |
|
26. |
Shuster D.P. Lefrak SS. Shock - Critical Care (JM Civetta, RW Taylor, RR Kirby eds), Lippincott, Philadelphia, 1992, pp.407-426 |
|
27. |
Şuteu I., Băndilă T., Bucur A., Şocul, Ed. Militară, Bucureşti, 1989, pp.445-455 |
|
28. |
Taylor A.E - Capillary fluid filtration. Starling forces and limph flow. Circ. Res 1981, pp.49:557-575 |
|
29. |
Toader C. Acalovski I. - Şocul. În: Patologia chirurgicală (ed. C. Toader) Ed. Didactică şi pedagogică. Bucureşti, 1975, pp.15-53 |
|
30. |
Westaby's Penetrating Wounds Pathogenesis and Treatment , London 1991, Heinnemann Medical Books |
|
31. |
Wilson R..T., Christensen C., Oxygen consumption in critically ill surgical patients, Ann. Surgery, 1982, pp. 676-801 |
|
32. |
Wilson R.F. - Critical Care Manual. Davis Co, Philadelphia, 1992 |
VALORI NORMALE ALE UNOR CONSTANTE BIOLOGICE FOLOSITE ÎN CADRUL LUCRĂRII
|
Adrenalină |
0,0002 m mol/L |
|
Angiotensină I (în plasmă sângelui venos) |
10-60 pg/mL 10-60 ng/L |
|
Angiotensină II (în plasma sângelui arterial) |
18-23 mEq/L 18-23 mmol/L |
|
Bicarbonat standard HCO3 sau StHCO3 (în ser) |
22-26 mmoli/L 22-26 mEq/L (vezi Exces baze) |
|
Capacitatea vitală |
50 ml/Kg |
|
Catecolamine(total) (în urină/24h) |
< 100 m g/dL<5,91 nmpl/dL |
|
CO2 total (TCO2) (Ser sau plasmă (+heparină)) |
23-29 mEq/L 23-29 mmol/L |
|
Consumul de O2 (VO2) |
250 ml/min |
|
Conţinutul în O2 al sângelui arterial (CaO2) |
20 ml/dL |
|
Conţinutul în O2 al sângelui venos (CvO2) |
15 ml/dL |
|
Diferenţa în O2 dintre sângele arterial şi cel venos (Ca-v O2) |
5ml/dL |
|
Epinefrină |
vezi Adrenalină |
|
Eritrocite (H) (în sângele integral) |
F:4-5, 1/pL M:4,5-5,9/pL |
|
Exces baze (EB) (în ser) |
±2 |
|
Fracţiunea de oxigen inspirat (FiO2) |
0,2 L (0.21) |
|
Hematocrit (Ht) (în sângele integral) |
M:39-50% F:36-45% |
|
Hemoglobină (Hb) (în sângele integral) |
M:13-17,5 g/dL 8,1-11,2 mmoli/L F:11-16 g/dL 7,2-9,8 mmoli/L |
|
Leucocite (L) (în sângele integral) |
4400-11300/ml Modificările leucocitelor totale reflectă de cele mai multe ori devieri ale neutrofilelor |
|
Methemoglobina |
0,06 - 0,24 g/dL 9,3 - 37,2 m mol/L |
|
Noradrenalină |
0,0013 m mol/L |
|
Norepinefrină |
vezi Noradrenalină |
|
pH sangvin |
7.35 - 7,45 |
|
Potasiu (K) |
3,5 - 5 mEq/L 4,5 mmol/L |
|
Presiunea maximă inspiratorie |
-40 cm H2O |
|
Presiunea parţială a CO2 (PCO2) (în sângele arterial integral (+heparină)) |
M:35-48 mmHg 4.66-6.38 KPa F:32-45 mmHg 4.26-5.99 KPa |
|
Presiunea parţială a CO2 în sângele arterial (PaCO2) |
40 mmHg |
|
Presiunea parţială a O2 (PaO2) (în sângele integral) |
70-100 mmHg 9,5 - 13,3 KPa |
|
Producţia de CO2 (VCO2) |
200 ml/min |
|
Ritmul respirator (R) |
12-22/min |
|
Saturaţia în O2 a sângelui venos (O2Sat v) |
70-75% |
|
Saturaţia în oxigen (O2ST) (în sângele integral) |
94-98% (scade cu vârsta) Modificările pO2 şi 02ST merg întotdeauna în acelaşi sens |
|
Sodiu (Na) |
136 - 145 mmol/L 136 - 145 mmol/L |
|
Sulfhemoglobina |
Ł 1,0 % din Hb totală |
|
Trombocite (Tr.) (în sângele integral) |
136-423/nl |
|
Ventilaţia pe minut (VE) |
6L/min |
|
Volumul sangvin |
M: 52 - 83 ml/Kg F: 50 - 75 ml/Kg |
|
Volumul ventilator rezidual (VD) |
150 ml |